![]()
Ciclos termoquímicos basados en carbonatos alcalinos y óxidos metálicos para la producción de H2 y gas de síntesis
En los últimos años han comenzado a aparecer nuevos ciclos termoquímicos para producción de hidrógeno y gas de síntesis, basados en los procesos originales propuestos en los años 70 pero con modificaciones en los materiales, con el fin de aumentar la eficiencia, empleando sustancias menos tóxicas y corrosivas que suponen una mejora medioambiental.
Autora: [Alicia Bayón Sandoval– Instituto IMDEA Energía]
La producción de hidrógeno mediante ciclos termoquímicos constituye una tecnología libre de emisiones contaminantes, y capaz de ser acoplada a los sistemas de concentración de energía solar, y que por tanto puede considerarse como un almacenamiento de esta fuente de energía en forma de enlaces químicos.
Dentro de los ciclos termoquímicos, los basados en óxidos metálicos están cobrando especial importancia en los últimos años. Estos procesos suponen el empleo de materiales los cuales son capaces de ser reducidos a temperaturas elevadas para, posteriormente, descomponer el agua (y el dióxido de carbono) y producir hidrógeno (o gas de síntesis, mezcla de H2 y CO) según sea conveniente dependiendo del producto demandado. En esta etapa se lleva a cabo la oxidación del material correspondiente, que estaría disponible para iniciar un nuevo ciclo. En los ciclos de dos etapas, requieren de las elevadas temperaturas de reducción >1500ºC, las cuales se encuentran lejos de los valores de temperatura de trabajo de las plantas de concentración solar actuales y de los reactores nucleares (700-1000ºC).
En este contexto, los investigadores del Instituto Tecnológico de California han propuesto una modificación de los materiales del ciclo termoquímico original de Na-Mn (NaOH-MnO), con el fin de facilitar la descomposición del agua en hidrógeno siguiendo el siguiente proceso:
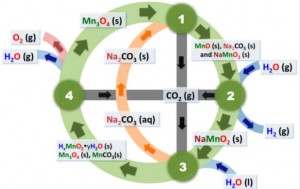
Figura 1: Esquema del ciclo termoquímico de Mn3O4/Na2CO3 [1]
En el esquema se observa cómo en una primera etapa, el Mn3O4 reacciona con carbonato para producir el óxido mixto NaMnO2 y MnO (1), formado a partir de la disociación del Mn2+ presente en la espinela Mn3O4. Posteriormente, el MnO junto con el Na2CO3 restante reaccionan con el H2O para producir hidrógeno y NaMnO2 a 850ºC(2). En la siguiente etapa, el óxido mixto formado se descompone mediante la extracción del Na+ de la estructura, empleando H2O a 80ºC, (3), formando materiales libres de sodio como el carbonato de manganeso y Mn3O4 inicial. Finalmente estos materiales se calcinan a 850ºC para recuperar todo el óxido de partida (4) mientras que el carbonato de sodio extraído es recirculado a la etapa de producción de hidrógeno (1), previa etapa de evaporación del agua.
Sobre este esquema inicial, los investigadores han estudiado varias modificaciones, como el empleo de carbonatos de potasio y litio (K2CO3 y Li2CO3), cuyas propiedades son similares a las del carbonato de sodio. En primer lugar se evaluó la producción de hidrógeno a partir de las distintas fuentes de carbonatos observándose que el carbonato de litio es el más activo de los tres compuestos para la formación de hidrógeno y que en la reacción con carbonato de potasio, el óxido de manganeso no fue capaz de oxidarse para producir hidrógeno. Sin embargo, el empleo del carbonato de litio en lugar del carbonato original, no supuso una ventaja añadida a la extracción iónica. En el óxido mixto LiMnO2, los iones Li+ no pueden intercambiarse por el H2O tan fácilmente como el sodio. Además en este estudio, se ha mejorado la eficacia de la extracción de sodio, mediante un burbujeo de CO2 en la suspensión del sólido NaMnO2.
También se ha sustituido el óxido metálico Mn3O4 por varias espinelas Fe3O4 y Co3O4. Cuando se empleó la espinela de cobalto (Co3O4) no se observó producción de H2 debido a que no se producía la oxidación del Co2+ a Co3+. En el caso de la espinela de hierro (Fe3O4) la producción de hidrógeno fue más efectiva para el empleo de las tres fuentes de carbonato, que la espinela de manganeso. Sin embargo, la extracción de iónica fue similar para el NaFeO2, comparado con el óxido mixto NaMnO2, y menos efectiva con el LiFeO2. De estos resultados se puede concluir que, para los óxidos estudiados cuanto mayor es la actividad en producción de hidrógeno el óxido mixto formado es más difícil de descomponer.).
Además de la producción de hidrógeno, la descomposición conjunta de CO2 y H2O se llevó a cabo con los sistemas anteriormente planteados. Se determinó que para esta reacción, la espinela de hierro es más activa para la descomposición. Sin embargo, el sistema Mn3O4/Na2CO3 ofrece unos rangos de temperatura de trabajo mucho más adecuados para la ser acoplados con la energía solar concentrada (reducción a 850ºC del Mn2O3, frente a 1150ºC del Fe2O3), lo cual minimiza las pérdidas energéticas derivadas del calentamiento y enfriamiento de los reactivos, concluyéndose que este sistema es el más apropiado para su aplicación en las condiciones de trabajo actuales.
[1] Biungjun X, Bhawe Y, Davis M. E. PNAS. 2012. DOI: 10.1073/pnas1206407109
[2] Biungjun X, Bhawe Y, Davis M. E. Chem Mat. 2013. DOI: 10.1021/cm3038747

Muy buena información. Este nuevo proceso suena muy interesante. En https://www.facebook.com/SurePlanet también han publicado notas de este tipo que puede ayudar. Saludos