![]()
Las células estrenan “modelito”
Por Blanca González Bermúdez (Universidad Politécnica de Madrid)
Cuando se habla de la célula, de su estructura, funciones, interacciones o posibles patologías, se mantiene muchas veces un enfoque bioquímico: el gen X codifica una proteína que regula el gen Y, el cual, a su vez, codifica la proteína Z, y así sucesivamente. Es natural que esto ocurra, ya que la biología celular se ha basado en principios bioquímicos -moleculares y genéticos-, para explicar el funcionamiento de las células. Pero, como siempre, la naturaleza hace las cosas un poco más complicadas.
El caso es que desde los años 70 sabemos que una buena parte de los procesos celulares están relacionados también con el comportamiento mecánico de las células. Por ejemplo, los glóbulos blancos se activan y se vuelven más deformables cuando detectan una infección. Ciertas enfermedades, como la malaria, provocan un aumento en la rigidez de los glóbulos rojos, y se ha observado que las células cancerosas se vuelven más flexibles, y por ello migran con mayor facilidad, que las células sanas. Aún más, las células son capaces de detectar la rigidez y las fuerzas mecánicas de su entorno. Una misma célula madre, por ejemplo, se puede diferenciar en una neurona o en un miocito cambiando simplemente la rigidez del sustrato.
En definitiva, se ha podido constatar que las propiedades mecánicas de las células pueden emplearse como biomarcadores del estado celular. Partiendo de esta idea, se han desarrollado en las últimas décadas varias técnicas experimentales para estudiar el comportamiento mecánico de la célula y las fuerzas que ejerce sobre su entorno: la microscopía de fuerza atómica, la aspiración con micropipeta, la citometría óptica y magnética, o la microscopía de fuerzas de tracción, entre otras.
En el laboratorio de Biomateriales (CTB-UPM), hemos puesto a punto la técnica de aspiración con micropipeta, que nos ha servido para comparar las propiedades mecánicas de células en distintas condiciones. Con este procedimiento podemos aspirar las células en suspensión mediante un microcapilar de vidrio, aplicando una diferencia de presión entre el interior del microcapilar y la muestra de células. Las imágenes del ensayo de aspiración se procesan automáticamente en un ordenador y obtenemos así la longitud aspirada de la célula en el interior del microcapilar en cada instante.
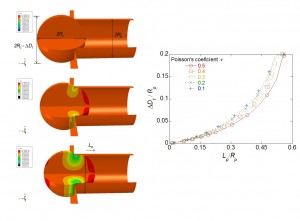
Pero nos quedaba una barrera pendiente: ¿qué modelo mecánico emplear en nuestros experimentos? En una célula hay diferentes orgánulos contenidos en el citoplasma, conectados entre sí por un entramado muy complejo, que apenas ahora estamos cartografiando con detalle. Esto ha supuesto que se hayan generado múltiples modelos mecánicos de la célula, si bien el desarrollo de un modelo que describa de manera integral el complejo comportamiento de las células sigue suponiendo un desafío en la actualidad. Para la técnica de aspiración con micropipeta, hay modelos que asumen que la célula se comporta como un sólido elástico lineal incompresible en pequeñas deformaciones, y que permiten calcular el módulo elástico de la célula en función de la presión y longitud aspirada en la micropipeta. También existen modelos para grandes deformaciones, que analizan la viscosidad aparente de las células asumiendo un comportamiento de fluido viscoso Newtoniano. Sin embargo, nos resulta curioso que los modelos más empleados para la aspiración de células con micropipeta no tengan en cuenta el tamaño finito de las células ni el contacto con la micropipeta. Además, asumen que las células son imcompresibles, es decir, que tienen un coeficiente de Poisson de 0,5.
Figura 1. Simulación numérica de la aspiración de células con micropipeta.
Con la intención de proponer una mejora en los modelos existentes para la aspiración de células con micropipeta, hemos desarrollado una metodología que permite calcular el módulo elástico y el coeficiente de Poisson de la célula aspirada. En este modelo numérico axisimétrico, de elementos finitos, consideramos el contacto de la célula con la micropipeta, mediante un radio de acuerdo, y hemos hallado una relación no lineal de la longitud aspirada de la célula con respecto a la presión de aspiración (figura1). También hemos comprobado que, empleando este modelo en ensayos de linfocitos, los valores del módulo elástico y coeficiente de Poisson que obtenemos son razonables para este tipo de células.
Los siguientes pasos de nuestra hoja de ruta van dirigidos a lograr automatizar aún más la técnica de aspiración de células con micropipeta, con el fin de aumentar el número de células analizadas por hora, de forma que un futuro pudiera aplicarse este modelo de trabajo al estudio de la deformabilidad de linfocitos T como biomarcador de la edad y funcionalidad. Pero eso es otro cantar.
Mientras llega ese momento, podemos al menos afirmar que las células ya pueden lucir “modelito” nuevo esta temporada.
Referencias:
- Rosowski K. Introduction to Cell Mechanics and Mechanobiology. The Yale Journal of Biology and Medicine. 2013;86(3):436-437.
- Worthen, G. S., Schwab, B. I. I. I., Elson, E. L., & Downey, G. P. (1989). Mechanics of stimulated neutrophils: cell stiffening induces retention in capillaries. Science, 245(4914), 183-186.
- Suresh, S., Spatz, J., Mills, J. P., Micoulet, A., Dao, M., Lim, C. T., … & Seufferlein, T. (2015). Reprint of: connections between single-cell biomechanics and human disease states: gastrointestinal cancer and malaria. Acta biomaterialia, 23, S3-S15.
- Suresh, S. (2007). Biomechanics and biophysics of cancer cells. Acta Materialia, 55(12), 3989-4014.
- Engler, A. J., Sen, S., Sweeney, H. L., & Discher, D. E. (2006). Matrix elasticity directs stem cell lineage specification. Cell, 126(4), 677-689.
- Di Carlo, D. (2012). A mechanical biomarker of cell state in medicine. Journal of Laboratory Automation, 17(1), 32-42.
- Bao, G., & Suresh, S. (2003). Cell and molecular mechanics of biological materials. Nature materials, 2(11), 715-725.
- Plaza, G. R., Marí, N., Gálvez, B. G., Bernal, A., Guinea, G. V., Daza, R., … & Elices, M. (2014). Simple measurement of the apparent viscosity of a cell from only one picture: Application to cardiac stem cells. Physical Review E, 90(5), 052715.
- Hochmuth, R. M. (2000). Micropipette aspiration of living cells. Journal of biomechanics, 33(1), 15-22.
- Esteban-Manzanares, G., González-Bermúdez, B., Cruces, J., De la Fuente, M., Li, Q., Guinea, G. V., … & Plaza, G. R. (2017). Improved Measurement of Elastic Properties of Cells by Micropipette Aspiration and Its Application to Lymphocytes. Annals of biomedical engineering, 45(5), 1375-1385.
- Inner life of the cell: https://www.youtube.com/watch?v=FzcTgrxMzZk