|
Historia - 1ª parte |
 |
J. J. Thomson, junto a otros investigadores, descubrió en 1897 que los átomos no eran indivisibles como se creía, sino que podían ser separados en componentes más pequeños. Asimismo, descubrió la composición de los átomos y la existencia de unas partículas que orbitaban en la zona exterior denominadas electrones, cuya masa era mucho menor que la del núcleo; éste, por su parte, tenía carga positiva y su peso suponía casi la totalidad del átomo en conjunto. A pesar de que no fue capaz de determinar la composición del núcleo, quedaron sentadas las bases para posteriores investigaciones, las primeras de las cuales se centraron en la estructura del átomo.
|
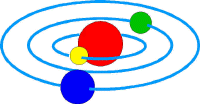
En 1911, Ernest Rutherford desarrolló una teoría del átomo basado en un sistema solar en miniatura |
El átomo consta de un núcleo de gran tamaño sobre el que flotan (orbitan) los electrones. Ernest Rutherford desarrolló en 1911 un modelo basado en un sistema solar en miniatura, en el que el núcleo era una estrella (un sol) y los electrones los planetas. La explicación de su teoría tenía sin embargo dos errores: que los electrones emitirían energía al girar, disminuyendo su velocidad y cayendo al núcleo; erróneo porque los electrones ocupan órbitas fijas. Otro error consistía en que los electrones podían saltar de una órbita a otra cualquiera alrededor del núcleo; sin embargo, se comprobó que los electrones sólo podían ocupar determinadas órbitas siempre iguales.
|
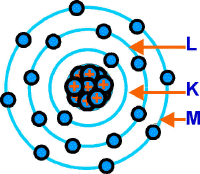
En 1913, Niels Bohr enunció una nueva teoría, hoy aceptada en líneas generales, que distribuía los electrones en capas de órbitas que poseían su propio nivel de energía. En la imagen, las tres capas de un átomo de cloro. |
En 1913 Niels Bohr enunció una nueva teoría atómica para dar solución a los fallos de la teoría de Tutherford; consistía en un sistema con un pequeño núcleo alrededor del cual giraban los electrones, pero con órbitas que obedecían a ciertas reglas restrictivas. Según esas reglas, sólo podrían existir un número determinado de órbitas y cada órbita tendría un nivel de energía, por tanto el electrón que ocupase una órbita concreta poseería la energía correspondiente a esa órbita. Asimismo, un electrón no podría saltar de una órbita a otra, salvo recibiendo una energía adicional igual a la diferencia de energía de ambas órbitas; si un electrón cambiara de una órbita de energía superior a otra inferior, emitiría igual cantidad de energía en forma de onda electromagnética, que sería de espectro fijo para los mismos tipos de átomos (una especie de sello identificativo).
La teoría de Bohr, a pesar de los adelantos en las explicaciones sobre la estructura de la materia, también contenía errores, aunque hoy es aceptada en líneas generales. Los electrones deberían emitir energía al girar alrededor del núcleo, invalidando que las órbitas fueran de energía constante. La teoría de la mecánica cuántica vino a solucionar estas interrogantes, mediante la enunciación del principio de la dualidad onda-partícula, por la cual toda partícula puede comportarse igualmente como una onda. Estas teorías y estudios fueron fruto del desarrollo y aportaciones de muchos y notables científicos como Schrödinger, Heisenberg, Dirac, Planck, Louis de Broglie, etc.
|
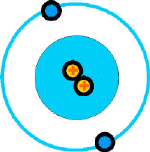 Átomo de helio |
|
Para poder mantener una carga neutra, los átomos poseen el mismo número de protones en el núcleo que de electrones en las órbitas |
La siguiente operación después de establecerse el sistema de las órbitas electrónicas, era determinar la estructura del núcleo. En estado normal un átomo no posee carga eléctrica, sin embargo, se observó que la carga del núcleo era positiva y siempre múltiplo de la carga del electrón; así pues, se concluyó que el núcleo estaba compuesto por un conjunto de partículas, cada una de ellas con igual carga que la del electrón, pero positiva; esas partículas fueron denominadas protones. Según este planteamiento, los átomos tienen el mismo número de electrones que de protones para poder mantener una carga neutra, es decir, cargas negativas en los electrones iguales a cargas positivas en los protones. El hidrógeno posee un electrón en su órbita, por tanto posee igualmente un protón en su núcleo; se dedujo así que el peso del protón era aproximadamente dos mil veces superior al del electrón; sin embargo, esta medida no se corresponde con la de otros elementos atómicos. La incógnita de las masas quedó despejada en 1932 cuando James Chadwick, de la Universidad de Cambridge, descubrió un nuevo elemento en el núcleo cuando estudiaba las colisiones entre partículas a alta velocidad, al que se le denominó neutrón. Quedó así definitivamente determinada la estructura del átomo.
El paso entre la determinación de la estructura de la materia y la teoría para la obtención de la energía nuclear por fisión lo dio Albert Einstein. Los experimentos sobre esta teoría demostraron que al bombardear un átomo pesado con otra partícula, las diversas partes en que se separaba el núcleo tenían en conjunto masas menores que la del núcleo original, liberándose por tanto una cantidad de energía. Si se aplicaba la fórmula de Einstein sobre la diferencia de masas, se observaba que los resultados eran coincidentes con los de la energía liberada.
Con el éxito en la ejecución de la teoría de Einstein se había encontrado una fuente de energía de enormes posibilidades, sin embargo en la práctica aún era inviable, el motivo era que experimentalmente siempre se consumía mayor energía que la que se producía. Estas limitaciones quedaron arrinconadas en 1939, cuando Lise Meitner y Otto Hahn descubrieron la facilidad con que podía ser partido el núcleo del uranio mediante un neutrón, el cual producía además otros tres neutrones que podían dividir a su vez otros núcleos, acelerando la propia radiactividad natural del uranio.
Superadas las limitaciones para generar energía nuclear aprovechable, en 1942 comenzó a funcionar en la Universidad de Chicago el primer prototipo de reactor nuclear, construido por Enrico Fermi. A finales de 1950 comenzaría una utilización práctica de esta energía para producir electricidad, con las primeras centrales nucleares de fisión.
La energía nuclear no sólo tuvo aplicación pacífica. Paralelamente a esa investigación se realizaban ensayos con fines bélicos. Cinco años antes de que se le diera a la fisión nuclear una aplicación práctica para la producción de energía eléctrica, fueron lanzadas dos bombas atómicas sobre las ciudades de Hiroshima y Nagasaki que causaron gravísimos daños, tanto en vidas humanas como materiales (véase el artículo El arma atómica).
La energía nuclear mediante la fisión de uranio supuso un paso tecnológico importante para la humanidad, pero con elevados costes ecológicos debido a los residuos radiactivos que produce, los cuales deben ser manejados con extremo cuidado, además de ser de complicado almacenamiento por el largo periodo de degradación que precisa. Véase el artículo: Los desechos radiactivos.
Los inconvenientes de la energía de fisión tienen su contrapunto en la energía de fusión. Esta técnica podría ser la solución a las demandas de una energía económica, ecológica y muy potente, aunque de momento en los experimentos siempre se ha consumido más energía que la que se produce.
La fusión nuclear consiste en la unión de varios átomos de pequeño tamaño (como el del hidrógeno) en otro de peso mayor; la energía que libera es muy superior a la que se obtiene mediante la fisión del uranio, cuyo átomo es muy pesado. Las grandes ventajas de este tipo de energía estriba en que, a diferencia del uranio, el hidrógeno es un elemento muy abundante en la naturaleza, además de que los residuos que produce pueden liberarse sin peligro alguno. Véase el artículo: La energía de fusión.