| |
Todos hemos visto alguna vez un vaso que se cae desde
una mesa y se hace añicos contra el suelo. Lo que antes estaba ordenado
en una única pieza de vidrio, se convierte en una multitud de fragmentos
desordenados. Pero la situación contraria, la recomposición de un vaso
a partir de sus fragmentos de manera espontánea, al menos que se sepa,
no la ha visto nadie. La ruptura del vaso es un suceso natural e irreversible,
una secuencia temporal adecuada; su recomposición, en cambio, no lo es.
Es la evolución natural del orden al desorden o, en términos científicos,
la natural tendencia del Universo a aumentar su entropía. Todos tenemos
una cierta idea, intuitiva, de lo qué significa orden y desorden, pero
desconocemos que el paso de una situación a la otra implica, de forma
indefectible, el final de todo movimiento, la muerte del Universo.
Imaginemos un gas encerrado en la mitad de una caja por
medio de un tabique que puede retirarse a voluntad. Para simplificar,
podemos suponer que el gas no es más que un conjunto de átomos que no
experimentan mutuamente ningún tipo de atracción o repulsión, es decir,
un conjunto de bolas rígidas que se mueven en direcciones aleatorias con
cierto tipo de velocidades y que chocan entre sí con cierta frecuencia.
¿Qué ocurre cuando se extrae el tabique? El gas pasa a ocupar, de forma
espontánea, el volumen de la caja entera. ¿Cuál es la razón de tal comportamiento?
Simplemente, que aquellos átomos que se movían en la dirección apropiada
ya no encuentran una pared en la que rebotar y, por lo tanto, continúan
su movimiento utilizando todo el espacio disponible.
Supongamos que el gas de nuestro modelo está compuesto,
únicamente, de cuatro bolas. Inicialmente, las cuatro bolas se encontraban
en la mitad de la caja. Al abrir el tabique, tenemos 16 posibilidades
de ordenar las cuatro moléculas en cada mitad de la caja (24);
de éstas, existe una sola posibilidad de tener las cuatro bolas a la derecha,
otra corresponde a encontrarlas todas en la izquierda, cuatro corresponden
a encontrar una sola bola a la derecha, otras cuatro a encontrar una a
la izquierda y, por último, hay seis posibilidades de encontrar dos bolas
a cada lado. Cada una de las 16 configuraciones distintas puede darse
de forma aleatoria, pero hay menos formas de encontrar todas las bolas
a la derecha que de encontrar dos a cada lado. Conclusión: es más probable
que haya dos bolas a cada lado.
Si esto sucede con cuatro
átomos, intentemos imaginar lo que sucedería con un número más cercano
a la realidad; por ejemplo, una caja de 1 cm3 con un gas a
temperatura ambiente y presión atmosférica contiene, aproximadamente,
1019 moléculas. La probabilidad de que todas las moléculas
se encuentren en la mitad de la caja es de una entre dos elevado a este
número, algo extremadamente improbable, pero no imposible. Es mucho más
frecuente la situación en que las moléculas se distribuyen, aproximadamente,
por igual en cada lado, habida cuenta que existen muchas más formas de
obtener estas configuraciones.

Ludwig Boltzmann
|
De este argumento se deduce que los sistemas tienden,
de manera espontánea, a adoptar aquella configuración que se puede
obtener de un mayor número de formas distintas. En la jerga de los
especialistas en mecánica estadística, se dice que tienden hacia
aquella configuración en que es mayor el número de estados accesibles.
Parece razonable definir una situación desordenada como aquella
que puede obtenerse de muchas maneras diferentes y, al contrario,
una situación ordenada como la que puede obtenerse de pocas formas
distintas. En definitiva, los sistemas evolucionan de forma espontánea
hacia el desorden.
¿Y todo esto, qué tiene que ver con la entropía?
La entropía no es más que la magnitud física que se obtiene de multiplicar
el logaritmo del número de estados accesibles por una constante,
la constante de Ludwig Boltzmann, llamada así en honor del eminente
físico vienés que descubrió esta fórmula. Por lo tanto, los sistemas
evolucionan espontáneamente siempre en el sentido de aumentar la
entropía. De manera análoga, puede afirmarse que toda transformación
que realiza un sistema en el que aumenta la entropía ocurre de modo
espontáneo y, al contrario, la entropía sólo puede decrecer en el
caso de que el entorno que rodea al sistema aumente su entropía
en un valor igual o superior al que ha decrecido en el sistema.
|
El punto de vista de la Termodinámica
Teóricamente, una transformación
puede realizarse de dos maneras distintas: de forma reversible -cuando
se puede deshacer el proceso- o de forma irreversible. Hemos visto que,
en el ejemplo del gas encerrado en una caja, al retirar el tabique se
iniciaba un proceso irreversible, pues resulta muy improbable que las
moléculas del gas vuelvan a coincidir todas en la misma mitad de la caja.
Sin embargo, podemos imaginar un procedimiento de expandir el gas de forma
reversible; por ejemplo, sustituyendo el tabique por un pistón, una pared
deslizante. Al ir retirando el pistón de forma suficientemente lenta,
para que no se produzca un brusco descenso de la presión y la temperatura,
se puede aumentar el volumen hasta alcanzar el total de la caja y, a su
vez, puede volver a comprimirse hasta su valor inicial.

Nicholas Léonard Sadi Carnot
|
Los procesos reversibles tienen la peculiaridad
de que, en ellos, el aumento o disminución de entropía del sistema
es exactamente el contrario al experimentado por el entorno, con
lo que se tiene siempre un aumento total de entropía nulo. Sin embargo,
ninguno de los procesos que tienen lugar en la naturaleza es reversible.
La difusión de un gas, la mezcla de dos líquidos, las deformaciones
inelásticas de un cuerpo, las reacciones químicas o la conducción
de calor desde un foco caliente a uno frío, son procesos irreversibles.
En ellos, la entropía del Universo aumenta siempre.
El físico francés Sadi Nicolas Léonard Carnot ideó,
en 1824, una máquina térmica teórica extraordinariamente sencilla,
que funcionaba de forma reversible mediante el intercambio de calor
que se establece entre un foco caliente y un foco frío: se absorbe
calor del foco caliente y se cede al foco frío, y en el proceso
se realiza un trabajo. Sin embargo, la cantidad de calor que se
cede al foco frío es siempre menor, de forma que no se puede convertir
todo el calor en trabajo mecánico, es decir, es imposible obtener
un rendimiento del 100%. Sólo hay una posibilidad de obtener un
rendimiento del 100%: cuando la temperatura del foco frío sea, exactamente,
de cero grados absolutos (-273,16 ºC, aproximadamente), lo cual
es imposible de alcanzar. Carnot demostró, además, que su máquina
térmica alcanzaba el máximo rendimiento teórico que se puede alcanzar
con una máquina.
|
Dado que el ciclo de Carnot
es reversible, en él la variación total de entropía es nula. Pero ya hemos
señalado que en la naturaleza no se dan procesos reversibles. Utilizando
este modelo teórico, podríamos identificar la entropía como una especie
de energía degradada, la que correspondería a la cantidad de energía que
no se puede transformar en trabajo debido a que el proceso es irreversible.
| |
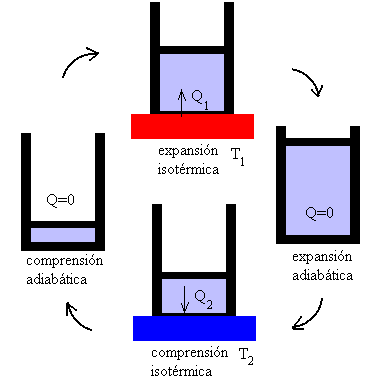
Representación esquemática del ciclo de Carnot
| |
Dado que en los procesos irreversibles siempre aumenta
la entropía del Universo, se puede concluir, en palabras de Boltzmann,
que "el segundo principio de la termodinámica anuncia un proceso
continuo de degradación de la energía, hasta que se agoten todas las energías
potenciales que pudieran producir trabajo y todos los movimientos visibles
del mundo", es decir, se anuncia una muerte cálida del Universo.
| |
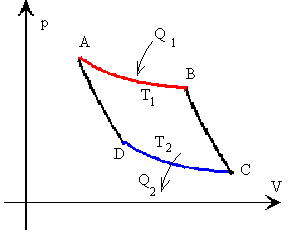
Tramo A-B: isoterma a la temperatura T1
Tramo B-C: adiabática
Tramo C-D: isoterma a la temperatura T2
Tramo D-A: adiabática
Representación gráfica del ciclo de Carnot en un
diagrama presión/volumen |
|
La identificación de los procesos espontáneos e
irreversibles que tienen lugar en la naturaleza con el aumento de
entropía del Universo ha llevado a varios autores a identificar
esta función termodinámica como una especie de flecha temporal;
durante los procesos espontáneos, el tiempo transcurre siempre en
el mismo sentido y la entropía aumenta. Esta identificación plantea,
a su vez, otra serie de interrogantes. Sabemos que nos encontramos
en un Universo en expansión. A largo plazo, pueden ocurrir dos cosas
distintas: que haya suficiente masa en el Universo como para que
esta expansión se vaya reduciendo y se invierta el proceso, o que
continúe para siempre. Que el Universo evolucione en uno u otro
sentido depende, únicamente, de la cantidad de materia existente,
lo cual no se ha podido determinar aún con exactitud. En caso de
que comenzara la contracción, el sentido de la entropía, en principio,
se invertiría: los procesos naturales darían lugar, aparentemente,
a un aumento del orden en el Universo. Esta posibilidad, tan atractiva
para los escritores de ciencia-ficción, resultaría de suponer que
la contracción del universo sería una especie de "película
hacia atrás", o inversión temporal, de la expansión del Universo.
Podríamos imaginar, por ejemplo, que una carretera mejorara su estado
con el uso continuado, por lo que no habría razón para construirla
con excesivo cuidado. Sin embargo, los modelos cosmológicos, aceptados
actualmente por la mayor parte de los científicos, predicen una
contracción del Universo, con sus flechas temporal y termodinámica
en el mismo sentido que hoy tienen: durante la contracción no tiene
porqué reconstruirse la misma estructura que tenemos durante la
expansión. Por otra parte, parece resultar inadecuado para la vida
un Universo en el que la flecha termodinámica se invierta. Como
señalara Stephen Hawking en su célebre obra Historia del tiempo,
la vida necesita consumir alimentos (energía ordenada), y transformarlos
en calor (energía desordenada).
|
 |
|
|











