Responsables:
Esmeralda Cuthbert
Antonio Colino
Javier Jiménez
Centro: I.E.S. San Fernando
Fuente: II Feria Madrid por la Ciencia 2000
Materiales
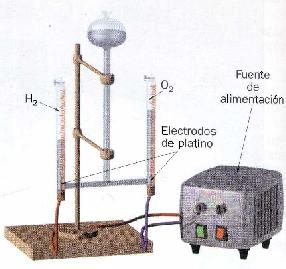
- Voltámetro de Hoffman con electrodos de platino
- Fuente de alimentación
- Tubos de ensayo
- Pinzas de madera
- Palillo plano de madera
- Un mechero de mano
- Agua y ácido sulfúrico
|
|
Procedimiento y explicación
El voltámetro de Hoffman permite realizar la electrólisis del agua de una forma muy cómoda recogiendo los gases hidrógeno y oxígeno en cada uno de los tubos, el doble de hidrógeno que de oxígeno. El agua debe contener una pequeña cantidad de ácido sulfúrico para mejorar su conductividad. En el tubo conectado en el electrodo del polo positivo se recoge oxígeno. Para comprobarlo podemos acercar el ascua de un palillo plano. Veremos como el oxígeno aviva la llama e incluso a veces se vuelve a encender. En el tubo conectado en el electrodo del polo negativo se recoge hidrógeno. Para comprobarlo proponemos hacer la reacción inversa a la electrólisis del agua: la síntesis del agua. Se abre la llave del tubo que contiene el hidrogeno y se recoge con un tubo de ensayo invertido. Se acerca una chispa de un mechero de mano (energía de activación) y el hidrógeno reacciona con el oxigeno del aire produciendo un estallido peculiar:
2 H2 (g) + O2 (g) = 2 H2 O
La electrólisis del agua nos permite:
- Comprobar que el agua es un compuesto de hidrógeno y oxígeno.
- Ver la relación en la que se encuentran estos gases: 2 volúmenes de hidrogeno por 1 de oxígeno. ¡Lafamosa H2O!
- Comprender la diferencia entre reacciones endotérmicas y exotérmicas.
|