| |
Responsable:
Elena Casañas Miranda
Brian Maudsley
Marta Torra
Centro: British Council School (Pozuelo de Alarcón)
Fuente:
Dirigido a: ESO y Bachillerato
Material
 Electrodos de cobre y cinc.  Diferentes frutas: limón, manzana, naranja, kiwi, etc.  Vinagre.  Refrescos variados.  Reloj de 1,8 V.  Voltímetro.  Cables y pinzas de cocodrilo.
|

|
Introducción
En nuestro stand proponemos una serie de juguetes ecológicos, juguetes que solo utilizan
energía renovable. No necesitan pilas ni electricidad… Aprovecharemos, pues, las fuentes
de energía limpia, segura, inagotable, que se renuevan continuamente. Energías que
no contaminan, y que cada vez son más baratas. Sin expoliar la naturaleza, sin emitir gases
tóxicos…
Fundamento científico
Teniendo en cuenta que en una pila una sustancia puede oxidar a otra, podemos conseguir
hacer funcionar un reloj con limones, manzana, refresco de cola, zumo de naranja…
Desarrollo
En una pila se produce una reacción química, una reacción redox en la cual las cargas
eléctricas circulan, van de un electrodo a otro.
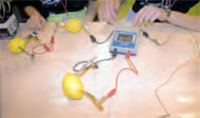 Nosotros utilizamos electrodos de cobre y cinc. En el cinc se produce la oxidación: es el
polo negativo de nuestra pila; en el cobre se produce la reducción: es el polo positivo. Nosotros utilizamos electrodos de cobre y cinc. En el cinc se produce la oxidación: es el
polo negativo de nuestra pila; en el cobre se produce la reducción: es el polo positivo.
Al elaborar una pila con un solo limón u otra fruta o refresco obtenemos un voltaje que varía
entre 0,8 V y 1 V, según la sustancia utilizada. Este voltaje es insuficiente para hacer funcionar
un reloj. Para ello, debemos conectar en serie tres frutas, que pueden ser iguales o no.
La única precaución que hay que tener es que los cables vayan del cobre al cinc, y que el
polo negativo del reloj se conecte al cinc, y el positivo, al cobre. Los electrodos no deben
estar en contacto.
|