![]()
Sulfinatos fluorados como fuente de radicales alquilo en la foto-enantiocontrolada β-funcionalización de enales
Autores: Ricardo I. Rodríguez, Marina Sicignano y José Alemán
Resumen: En los últimos años, la fotoquímica ha demostrado ser capaz de encontrar nuevas vías de activación y reacción en condiciones suaves y respetuosas con el medio ambiente, que serían imposibles por medios convencionales. En este sentido, hemos enfocado nuestra investigación en el desarrollo de nuevas metodologías útiles promovidas por la luz visible que involucran el control y adición de radicales libres. En concreto, hemos reportado la β-funcionalización de aldehídos insaturados de una manera altamente enantioselectiva utilizando sulfinatos fluorados como fuente de radicales alquílicos. La irradiación con luz azul y el uso de un organo-catalizador quiral son suficientes para inducir un evento de oxidación-reducción tanto en lote como en flujo, logrando la formación de productos con valor añadido, es decir aldehídos fluorados enantioenriquecidos. Se trata de moléculas pequeñas de gran interés en el campo médico y farmacéutico por sus propiedades atractivas y bioisostéricas. Aunado a esto, la economía atómica de la transformación es notable, siendo dióxido de azufre el único subproducto de la reacción.
Abstract: The generation of sulfonyl radicals has long been known as a flexible strategy in a wide range of different sulfonylative transformations. Meanwhile their use in alkylation processes has been somehow limited due to their inherent difficulty in evolving to less-stable radicals after sulfur dioxide extrusion. Herein we report a convenient strategy that involves gem-difluorinated sulfinates as an “upgrading-mask”, allowing these precursors to decompose into their corresponding alkyl radicals. The electron–donor character of sulfinates in the formation of an electron donor–acceptor (EDA) complex with transient iminium ions is displayed, achieving the first example of a stereocontrolled light-driven insertion of gem-difluoro derivatives into unsaturated aldehydes. This methodology is compatible with flow conditions, maintaining identical levels of enantiocontrol.
Hemos desarrollado una metodología enantioselectiva sin precedentes para la preparación de compuestos fluorados de gran interés en química médica y farmacéutica, utilizando luz visible en batch y en flujo.
Actualmente, la cantidad de fármacos y agroquímicos que contienen flúor es abrumadora. Esto se debe al hecho de que la inserción de átomos de flúor en la estructura de cualquier molécula orgánica afecta fuertemente sus propiedades físicas y bioquímicas iniciales. Este comportamiento está relacionado con varias características del flúor, por ejemplo, que es el elemento más electronegativo de la tabla periódica conduciendo a la formación de enlaces C-F altamente polares y fuertes (108 kcal/mol), o, por su baja polarizabilidad, modulando las interacciones intermoleculares. Además, el pKa de funcionalidades proximal a átomos de flúor sufren una gran variación afectando la solubilidad, la lipofilicidad, la permeabilidad así como la interacción con proteínas de la molécula entera. En particular, los fragmentos de difluorometilo (-CF2H) o difluorometileno (-CF2-) han atraído un gran interés por sus propiedades bioisostéricas de los grupos hidroxilo y oxígeno etéreo. Todavía, la falta de métodos versátiles y quimioselectivos para su introducción o el uso de reactivos con fuerte impacto ambiental, mantiene su expansión en el campo farmacéutico como una limitación. Por lo tanto, la búsqueda de nuevos métodos hacia la instalación estereocontrolada de los grupos CF2H- and CF2– en moléculas diferentes resulta de gran utilidad.
En este contexto, hemos ideado una estrategia utilizando gem-difluoro sulfinatos como precursores de radicales alquílicos fluorados a través de su descomposición oxidativa promovida por la luz visible y liberando dióxido de azufre como único subproducto. Además, hemos seleccionado materiales de partida sencillos y abundantes como aldehídos α,β-insaturados y un derivado de prolina como catalizador quiral, haciendo este proyecto atractivo y ventajoso desde un punto de vista sintético.
Durante la investigación, hemos encontrado que el carácter donante de electrones de los sulfinatos induce la formación de un complejo donador-aceptor de electrones (EDA) con iones de iminio, promoviendo así la adición del radical alquílico hacia la cara menos impedida de la enamina reducida y la siguiente generación del producto deseado mediante un mecanismo de recombinación de radicales.
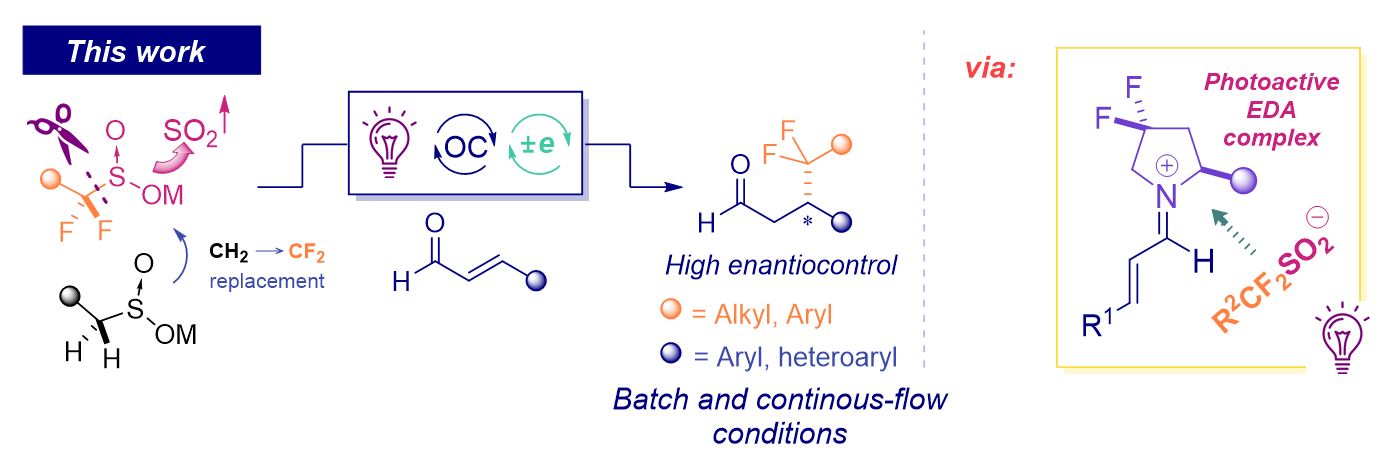
El resultado es el desarrollo del primer ejemplo de inserción estereocontrolada de derivados de gem-difluoro en aldehídos insaturados con alto rendimiento y enantiocontrol. Es importante mencionar que controlar el curso estereoquímico de una reacción radicalaria sigue representando un reto para la comunidad científica. Además, el impacto de este trabajo es evidente considerando que se trata de unos de los pocos ejemplos de literatura sobre la organo-fotocatálisis asimétrica, perfectamente en línea con el Premio Nobel de Química 2021 recibido por los profesores Benjamin List y David MacMillan por el gran impacto de la organocatálisis en la investigación farmacéutica y en la química verde.
Así, hemos demostrado una gran versatilidad y tolerancia a diferentes grupos funcionales, extendiendo el protocolo tanto a cinamaldehídos diferentemente sustituidos como a una amplia gama de sulfinatos por la enserción de difluorometileno y de fragmentos difluoroalquilicos y difluoroarilicos. Los buenos rendimientos y generalmente buenas hasta excelentes enantioselectividades obtenidas fueron llevadas a cabo en reacciones en batch y en flujo, en este último con tiempos de residencia de solo 10 minutos. Asombrosamente la transformación funcionó también mediante la utilización de luz solar. Además, preparamos compuestos bioactivos como el ácido carboxílico correspondiente, molécula clave para la preparación de una amplia familia de inhibidores, la amida derivada, así como el heterociclo 1,2,4-oxadiazol, atractivo por su alta demanda en el descubrimiento de fármacos.
Referencia
Rodríguez, R. I.; Sicignano, M; Alemán, J. “Fluorinated Sulfinates as Source of Alkyl Radicals in the Photo-Enantiocontrolled β-Functionalization of Enals” Angew. Chem. Int. Ed. 2022, 61, e202112632.
Contacto
José Alemán, Responsable del Grupo FRONCAT e Investigador responsable del Grupo FRUAM del Programa FotoArt-CM – jose.aleman@uam.es, www.uam.es/jose.aleman
Coordina FotoArt-CM: Víctor A. de la Peña O´Shea, Instituto IMDEA Energía.