![]()
COMPUTACION BIOLOGICA o el por qué una BACTERIA y un SUPER COMPUTADOR son tan parecidos
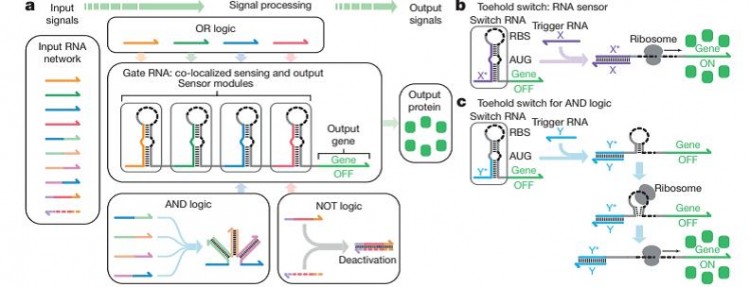
por Mario Aguilar Herrador Alan Turing, matemático y criptógrafo británico, el cual es considerado uno de los padres de la informática, ya flirteaba en los años 50 con la posibilidad de utilizar ordenadores para entender mejor los procesos biológicos complejos. En 1959, Richard Feynman dio una visionaria charla describiendo la posibilidad de construir ordenadores que era “submicroscópicos”. Desde el desarrollo de modelos matemáticos sobre la morfogénesis (proceso por el cual un organismo adquiere una forma determinada); hasta la inteligencia artificial,…
