![]()
Producción de H2 mediante ciclos termoquímicos basados en perovskitas empleando energía solar de concentración
Autores:
Alejandro Pérez, María Orfila, María Linares, Raúl Molina, Raúl Sanz, Javier Marugán, Juan Ángel Botas
Grupo de Ingeniería Química y Ambiental, Universidad Rey Juan Carlos
C/ Tulipán, s/n, 28933, Móstoles, Madrid.
La volatilidad en los precios de los combustibles fósiles (carbón, petróleo y gas natural), el agotamiento de las reservas y la emisión de gases contaminantes que contribuyen al calentamiento global de la atmósfera son tres de las mayores preocupaciones a nivel mundial. Por este motivo resulta necesario buscar fuentes de energía alternativas que sean limpias y no contaminantes, las conocidas como energías renovables como las energías eólica, solar, hidráulica, geotérmica. Pero también es necesario buscar combustibles alternativos.
Es en este punto donde aparece el interés de utilizar el hidrógeno como vector energético capaz de producir energía de manera limpia y sostenible (1). No obstante, el hidrógeno no se encuentra como materia prima libre en la Tierra, sino que es necesaria su obtención a partir de otros compuestos que lo contienen en su composición, como agua, gas natural e incluso otros hidrocarburos ligeros. Pero siempre teniendo en cuenta que, para que el hidrógeno sea realmente un combustible alternativo, su producción debe ser sostenible.
Actualmente hay muchos grupos de investigación trabajando en la búsqueda de metodologías alternativas para la producción de hidrógeno, siendo uno de los métodos más destacados su producción a partir de agua como materia prima y usando la radiación solar como fuente de energía. Utilizando estos recursos, son tres los métodos con mayor desarrollo para la obtención de hidrógeno descomponiendo la molécula de agua: procesos fotoquímicos (usan los fotones de la luz), electroquímicos (usan energía eléctrica) y termoquímicos (usan energía térmica) (2).
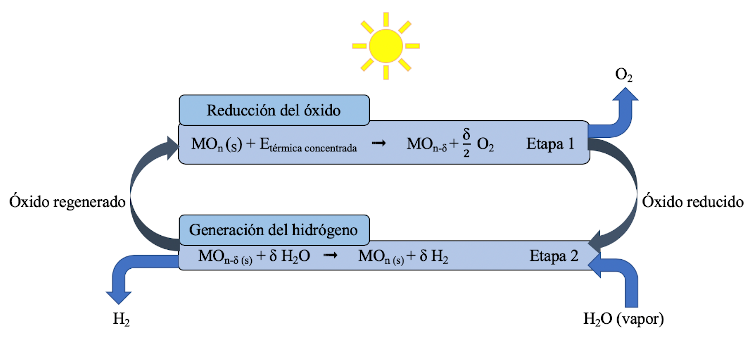
Para llevar a cabo la descomposición térmica del agua en sus componentes hidrógeno y oxígeno con conversiones significativas, son necesarias temperaturas superiores a 2500ºC. Además, se necesitan técnicas que eviten la recombinación del hidrógeno y el oxígeno a las elevadas temperaturas de operación (3). Sin embargo, mediante los ciclos termoquímicos también se puede conseguir la descomposición del agua en sus componentes, y trabajando a menores temperaturas. En la figura 1 se muestra el esquema de un ciclo termoquímico basado en óxidos metálicos (MOn). En la primera etapa del ciclo, el óxido es calentado con la energía solar de concentración produciéndose su reducción térmica acompañada de la producción de oxígeno. En la segunda etapa del ciclo, el óxido reducido (MOn-δ) reacciona con agua, produciendo hidrógeno y regenerando el óxido inicial. De esta manera, el hidrógeno y el oxígeno se obtienen en dos corrientes separadas, evitando su recombinación.
Figura 1. Esquema global de un ciclo termoquímico basado en óxidos metálicos MOn/MOn-δ.
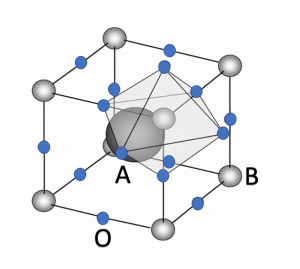
El Grupo de Ingeniería Química y Ambiental de la Universidad Rey Juan Carlos trabaja en la búsqueda y desarrollo de óxidos metálicos que puedan ser empleados en estos ciclos termoquímicos, en el marco de proyectos de investigación financiados por la Comunidad de Madrid como SOLGEMAC, ALCCONES y ACES2030. Entre los materiales más estudiados, destaca el óxido de cerio puro y modificado con otros metales (4), sin embargo, su alta temperatura de operación (1300-1500ºC) promueve la búsqueda de alternativas, entre las que destacan las perovskitas. Las perovskitas, son unos materiales que reciben su nombre en honor al mineralogista Lew A. Perowski que los descubrió en 1839 como un mineral de composición CaTiO3 (5). La estequiometría general de las perovskitas es ABO3, siendo “A” un metal alcalinotérreo o lantánido y “B” un metal de transición, ambos cationes de tamaños diferentes (6), siendo cúbica la estructura más común como se puede observar en la figura 2.
Figura 2. Estructura de una perovskita tipo cúbica ABO3.
A continuación se indica el comportamiento que presenta este tipo de material en las reacciones que se producen en ciclos termoquímicos redox:
ABO3 ➟ ABO3-δ + δ/2 O2 (Ec. 1)
ABO3-δ + δ H2O ➟ ABO3 + δ H2 (Ec. 2)
Donde “δ” es el grado de reducción que se produce. En la primera etapa, la perovskita se reduce térmicamente de forma que libera parte de los átomos de oxígeno de su estructura, formando de este modo vacantes de oxígeno en la misma. En la segunda etapa, la especie oxidante (H2O) se disocia formando los compuestos que se desean con este tipo de proceso, H2, y logrando así la reoxidación de la perovskita a su estado inicial.
No obstante, también existen estructuras de perovskitas complejas, en las que los cationes A y B pueden ser parcialmente sustituidos por otros distintos (A1-xA’xB1-xB’xO3) permitiendo realizar numerosas combinaciones en busca de mejorar las propiedades redox y conseguir que la temperatura requerida para el proceso termoquímico sea la menor posible (7).
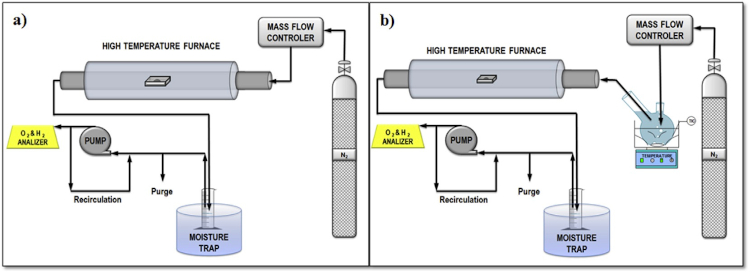
Es en este punto donde se centran las últimas investigaciones del grupo, que, además de demostrar con estudios realizados con perovskitas comerciales de tipo La1-xSrxMeO3 (Me = Mn, Co y Fe) su aplicación en la producción de hidrógeno en ciclos termoquímicos (8), se están sintetizando diferentes formulaciones de perovskitas empleando métodos de síntesis que resulten óptimos y eficientes. Entre los métodos de síntesis usados destacan el método Pechini, basado en una síntesis del tipo sol-gel, y la síntesis por mezcla física de alta intensidad. Tras las síntesis de las perovskitas, éstas son caracterizadas mediante diferentes técnicas y probadas en reacción en una instalación experimental como la que se muestra esquemáticamente en la figura 3, que permite alcanzar la temperatura de reacción y registrar de forma continua la producción de hidrógeno y oxígeno.
Figura 3. Esquema de la instalación experimental de reacción con horno tubular de alta temperatura: a) configuración de la etapa de reducción, y b) configuración de la etapa de hidrólisis (8).
Por todo ello, puede decirse que las perovskitas se presentan como unos materiales con gran interés y proyección en la producción de hidrógeno mediante ciclos termoquímicos que usan energía solar, debido a su gran variedad de composiciones y de métodos de síntesis. Por otra parte, además de su aplicación en estos procesos, las perovskitas se presentan como materiales potencialmente sustitutos del silicio en la producción de las células fotovoltaicas para placas solares por lo que nos encontramos ante una familia de materiales con un gran abanico de oportunidades y posibilidades de cara al futuro de las energías renovables.
Bibliografía:
1 Roeb M., Monnerie N., Houaijia A., Thomey D., Sattler C. Solar thermal water splitting. Renew Hydrogen Tech., 2013;4,20-23.
2 Rao C.N.R. and Dey S. Solar thermochemical splitting of water to generate hydrogen. Proc Natl Acad Sci USA, 2017;114;51;1339.
3 Orfila M., Linares M., Molina R., Botas J.A., Sanz R., Marugán J. Estudio de diferentes óxidos no estequiométricos para la producción de hidrógeno. XVI Congreso Ibérico y XII Congreso Iberoamericano de Energía Solar. Madrid, junio 2018. España.
4 Orfila, M., Sanz, M., Linares, M., Molina, R., Sanz, R., Marugán, J., Botas, J.A. H2 production by thermochemical water splitting with reticulated porous structures of Ceria-based mixed oxide materials. Int. J. Hydrogen Energ., 2020; in press.
5 Steinfeld A. Solar thermochemical production of hydrogen a review. Solid State Energ, 2005;78:603-15.
6 Tanaka, H., M. Advances in Designing Perovskite Catalysts. Solid State Mater., 2001;5:80-81.
7 Charvin P., Abanades S., Lemort F., Gilles F. Analysis of solar chemicals processes for hydrogen production from water splitting thermochemical cycles. Energ Convers Manage., 2009;49:1547-56.
8 Orfila M., Linares M., Molina, Botas J.A., Sanz R., Marugán J. Perovskite materials for hydrogen production by thermochemical water splitting. Int. J. Hydrogen Energ., 2016;41:19329-38.
Contacto:
Juan Ángel Botas, Investigador del Grupo URJC-SOLAR del Programa ACES2030-CM, juanangel.botas@urjc.es
Coordina ACES2030-CM: Manuel Romero Álvarez. IMDEA Energía