![]()
Estudio de materiales para su aplicación en la producción de hidrógeno mediante ciclos termoquímicos empleando energía solar concentrada
Autora: C. Caravaca. CIEMAT
El desarrollo industrial ha hecho que el uso y la necesidad de fuentes de energía hayan crecido exponencialmente. Esta energía ha sido proporcionada principalmente por combustibles fósiles como el carbón, el petróleo y el gas natural, que a pesar de su propiedades muy útiles, tienen una duración limitada y emiten gran cantidad de contaminantes medioambientales (CO, CO2, CnHm, SOx, NOx, metales pesados, cenizas, etc) [1].
A finales de los años 70 y principios de los años 80 con la crisis del petróleo creció el interés por la búsqueda de fuentes de energía alternativas. Entre los combustibles seguros, no contaminantes y eficaces que sustituyan a los combustibles fósiles se encuentra el hidrógeno. El hidrógeno es capaz de generar energía a través de un proceso limpio que conduce a la formación de agua como único producto. La energía química liberada se puede aprovechar directamente o se puede transformar en energía eléctrica por medio de las pilas de combustible o los motores de combustión de alto rendimiento.
Sin embargo, el hidrógeno no es una materia prima, sino que ha de obtenerse a partir de compuestos que lo contienen como son el gas natural, los hidrocarburos ligeros o el agua. Actualmente, el 96% de esta producción mundial de hidrógeno se obtiene a partir de materias primas fósiles (petróleo, gas natural y carbón), el 3,9 % mediante electrolisis de agua y el 0,1% restante mediante otros métodos [2].
Uno de los procesos limpios de producción de hidrógeno a partir de agua se basa en la utilización de energía solar. Esta fuente de energía no convencional es muy valiosa, ya que posee reservas esencialmente ilimitadas. Sin embargo, presenta ciertas desventajas en cuanto a que la radiación solar que llega a la tierra es muy diluida (sólo 1 kW/m2), intermitente (disponible durante el día) y está distribuida de manera desigual sobre la superficie terrestre [3]. Los métodos de obtención de hidrógeno utilizando energía solar se engloban en 3 grupos: procesos fotoquímicos, electroquímicos y termoquímicos, aunque también existen combinaciones de los anteriores.
La descomposición térmica del agua en hidrógeno y oxígeno requiere temperaturas superiores a 2.500 °C para obtener grados de conversión significativos. Los productos de la descomposición H2(g) y O2(g) han de ser enfriados para evitar su recombinación y posteriormente hay que separar las dos corrientes gaseosas.
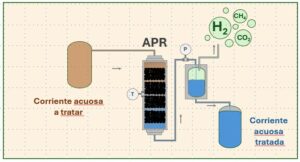
Los ciclos termoquímicos que emplean óxidos metálicos utilizan la energía solar concentrada como fuente calorífica de alta temperatura para lograr la conversión de agua en hidrógeno y oxígeno mediante una serie de reacciones endotérmicas y exotérmicas, es decir, transforman la energía térmica en energía química [4]. Como se muestra en el esquema de la Figura 1, mediante estos ciclos es posible realizar la descomposición térmica del agua a temperaturas inferiores que en la descomposición directa y además, las corrientes de H2(g) y O2(g) se obtienen en etapas separadas lo que evita tener que realizar una etapa de separación posterior .La primera etapa del ciclo consiste en un proceso endotérmico en el que se produce la reducción del óxido metálico en metal o en un óxido de menor valencia. La segunda etapa consiste en un proceso exotérmico de descomposición del agua en hidrógeno a la vez que se regenera el óxido inicial.
Los materiales empleados en los ciclos deben cumplir una serie de criterios como son el rendimiento de reducción térmica y de producción de hidrógeno, las cinéticas de las reacciones químicas, mantener su estructura a lo largo de ciclos repetitivos, toxicidad, disponibilidad y coste de los reactivos, fácil manejo de los materiales o la separación de los productos finales.
 Figura 1. Esquema general de un ciclo termoquímico basado en óxidos metálicos.
Figura 1. Esquema general de un ciclo termoquímico basado en óxidos metálicos.
En la actualidad se están estudiando varios ciclos termoquímicos basados en óxidos metálicos aunque todavía no se dispone de un dispositivo industrial. Entre los materiales estudiados se encuentra el ciclo basado en el ZnO; presenta el inconveniente de que la etapa de reducción requiere una temperatura muy elevada (~ 1700 °C) y es necesaria un etapa posterior de separación y concentración de los productos obtenidos durante la etapa de reducción, Zn(g) y O2(g), ya que durante el proceso de enfriamiento tienden a recombinarse. El enfriamiento rápido de los productos o “quenching” evita su recombinación pero supone un gasto extra de energía [5].
Los ciclos basados en óxidos de metales de transición como TiO2/TiOx, Co3O4/CoO se han desarrollado y probado en reactores solares, pero el rendimiento de hidrógeno generado es bajo para su aplicación a escala industrial. Otro de los ciclos está basado en el óxidos de hierro, la magnetita (Fe3O4) es una ferrita que forma parte del ciclo Fe3O4/FeO. Este ciclo también requiere temperaturas elevadas en la etapa de reducción (1600 °C) y un enfriamiento rápido o “quenching” para evitar la recombinación de los productos de la reacción. Se ha investigado la sustitución parcial de hierro de las ferritas por otros metales como Mn, Mg, Co o Ni para formar óxidos mixtos (Fe1-xMx)3O4), los cuales pueden ser reducidos a menor temperatura generando fases reducidas (Fe1-xMx)1-yO) que son capaces de descomponer el agua y producir hidrógeno. Sin embargo, existen ciertos inconvenientes como el necesario “quenching”·de los productos de reducción, la posible sinterización y en ocasiones la baja producción de hidrógeno
Uno de los ciclos que presenta mejores rendimientos con velocidades de reacción elevadas en las dos etapas y que poseen gran ciclabilidad es el basado en el CeO2. Sin embargo, la reducción estequiometrica a Ce2O3 requiere temperaturas muy elevadas (2000 °C), lo que hace casi imposible su utilización con instalaciones de concentración solar en gran escala [6]. Se han realizado estudios empleando materiales de CeO2 dopados con distintos metales de transición, lantánidos o Zr [7-9] en las que la reducción es no-estequiometrica y se realiza temperaturas considerablemente inferiores (1400-1500C). Los rendimientos de reducción, aunque aceptables, son inferiores a los del CeO2, excepto en el caso del Zr, sin embargo, se ha indicado que este tipo de materiales pierde actividad con el ciclado.
Desde hace varios años en el CIEMAT se vienen estudiando procesos de ciclos termoquímicos para la producción de hidrógeno mediante energía solar concentrada. Concretamente, se han estudiado ciclos basados en ferritas dopadas con distintos metales, se han ensayado tanto óxidos comerciales como sintetizados en el CIEMAT. Entre los que presentaban mejores resultados está la ferrita de Ni [10]. Entre los inconvenientes de este material se encuentra la elevada temperatura requerida para lograr rendimientos de reducción aceptables (1400- 1450°C). esta elevada temperatura produce una sinterización del material y la formación de dos fases de tipo NiO y FeO. Además, las cinéticas de las reacciones son lentas.
Actualmente, una de las actividades en las que está involucrado el CIEMAT dentro del proyecto ALCCONES es el estudio de nuevos materiales óxidos que permitan reducir la temperatura necesaria para llevar a cabo la etapa de reducción, con alta producción de hidrógeno y cinéticas rápidas. Los materiales considerados son óxidos de tipo perovskita, de fórmula ABO3. La estructura perovskita ideal es cúbica, y se deben cumplir una serie de reglas en cuanto a los radios iónicos de los cationes A y B y además, se debe cumplir la neutralidad electrónica de manera que la carga de A+B sea igual a la carga de los aniones oxígeno; lo cual se logra mediante la distribución de carga. Esto unido al hecho que los cationes A y B pueden tener diferentes valencias produce defectos y distorsiones de la estructura perovskita que pueden dar lugar a materiales deficientes en oxígeno cuyas propiedades redox son las adecuadas para los ciclos termoquímicos.
Los materiales considerados inicialmente son perovskitas del tipo: La1-xSrxB1-yBy’O3 (B, B’ =Mn, Al, Co, Fe). Los materiales son sintetizados mediante un proceso sol-gel y posteriormente calcinados a las temperaturas adecuadas para formar la fase perovskita, la cual se caracteriza mediante análisis de difracción de rayos X. Hasta el momento se han sintetizado tres compuestos y se ha comenzado a probar su comportamiento durante la etapa de reducción. Dichos ensayos se están realizando en termobalanza para determinar su grado de reducción de estos compuestos y los resultados se comparan con los obtenidos con CeO2, considerado como material de referencia.
Esta investigación se está llevando a cabo gracias a la financiación del proyecto ALCCONES financiado por la comunidad de Madrid- REF. P2013/MAE2985.
Bibliografía:
[1] M. Momirlan and T. N. Veziroglu. Renewable & Sustainable Energy Reviews, 2002, 6 (1-2) 141-179.
[2] Ewan, B.C.R. and R.W.K. Allen. Int. J. Energy, 2005, 30(8), 809-819.
[3] Serpone, N., D. Lawless, and R. Terzian. Solar Energy, 1992. 49(4): p. 221-234
[4] A. Steinfeld. Solar Energy, 2005. 78(5): p. 603-615.
[5] Palumbo, R., et al. Chem. Eng. Sci., 1998. 53(14): p. 2503-2517..
[6] Abanades, S. and G. Flamant. Solar Energy, 2006. 80(12): p. 1611-1623
[7] Kaneko, H., et al. Energy, 2007. 32(5): p. 656-663
[8] Demont, A., S. Abanades, and E. Beche. J. Phys. Chem. C, 2014. 118(24): p. 12682-12692.
[9] Le Gal, A., S. Abanades, and G. Flamant. Energy & Fuels, 2011. 25(10): p. 4836-4845.
[10] Fernández-Saavedra, R., et al. Int. J. Hydrogen Energy, 2014, 39(13): p.