![]()
Síntesis enantioselectiva de pirrolo-derivados mediante Fotocatálisis: una curiosa reacción en cascada radicalaria/polar
Autores: Ricardo I. Rodríguez, Leonardo Mollari y José Alemán
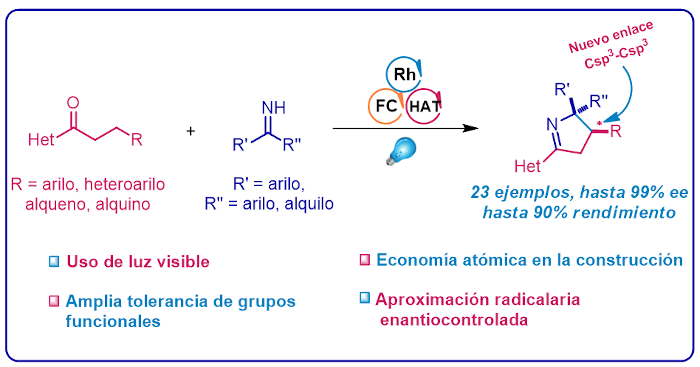
Resumen: El renacimiento de la fotoquímica ha promovido durante la última década la generación de nuevas reacciones que hasta la actualidad permanecía olvidada en la bibliografía. Bajo esta premisa, hemos centrado nuestra investigación en el desarrollo de nuevas transformaciones usando la luz visible como promotor de radicales libres. En concreto, hemos logrado la síntesis de derivados de pirrolidina teniendo en cuenta la economía atómica de la transformación, donde el único subproducto de la reacción es agua. Esta metodología utiliza materiales de partida abundantes y ofrece una alternativa eficaz cuando se busca la preparación de iminas cíclicas ópticamente activas; enfatizando que estas últimas usualmente son encontradas en productos de alto interés tanto biológico como farmacéutico. Aunado a esto, el trabajo pone de manifiesto la gran versatilidad de los productos obtenidos, tras su utilización en distintas transformaciones para dar lugar a productos de valor añadido.
Abstract: A light-driven, atom-economical strategy that unlocks access to enantioenriched substituted chiral 1-pyrroline derivatives is introduced. The methodology lays in the distal functionalization of acyl heterocycles enabling a hydrogen atom transfer (HAT) and the use of tailored made ketimines as reliable electrophilic partners. This transformation is translated to an enantiocontrolled radical/polar cascade reaction, producing water as sole by-product, where stereocontrol is dictated by coordination to a chiral-at-rhodium catalyst.
Hemos descrito una nueva una metodología enantioselectiva, mediante la utilización de luz visible, para dar lugar a iminas cíclicas que son sustratos de alto interés biológico y farmacéutico.
Las aminas e iminas cíclicas son heterociclos que presentan un átomo de nitrógeno en su estructura y su presencia es amplia en productos naturales como el ácido Kaínico (prototitpo de aminoácido convulsivante en animales de experimentación) o alcaloides como la nicotina (estimulante del sistema nervioso). Por otra parte, fármacos como el Veliparib (antitumoral) y algunos ligandos quirales usados en síntesis asimétrica, confirman también su importancia. En este contexto, han sido distintos los métodos de preparación que ofrecen acceso a este tipo de arquitecturas moleculares. Sin embargo, su implementación involucra el uso de materiales de partida complejos o necesitan de condiciones de reacción drásticas (p.ej. alta temperatura). Por esto, la búsqueda de nuevos métodos de síntesis más eficaces y predecibles resulta de gran utilidad en la química orgánica moderna. En este punto, es importante destacar que controlar el curso estereoquímica de una reacción radicalaria sigue representando un reto para la comunidad científica, y por tanto, una motivación para el desarrollo de nuevas estrategia en el campo
En este trabajo nos planteamos la posibilidad de generar un radical centrado en un átomo de carbono alquílico su adición estereocontrolada a una imina comercialmente disponible. Teóricamente esto promovería una reacción en cascada para la posterior formación de un heterociclo enantioenriquecido. A pesar del gran desarrollo del área de la fotocatálisis y de la importancia de las iminas cíclicas en la creación de moléculas más complejas, la formación de estos productos empleando luz visible de una manera asimétrica no había sido logrado hasta el momento. El grupo de investigación FRONCAT (www.uam.es/jose.aleman), liderado por el profesor Alemán, ha descrito la construcción de heterociclos nitrogenados tipo pirrol de forma enantioselectiva, siguiendo una peculiar estrategia: el uso de un catalizador con quiralidad centrada en el metal a base de rodio. Esta idea, no solamente ofreció la posibilidad de comandar el curso estereoquímico de la transformación, sino también la disminución de la energía de disociación de enlace C-H, permitiendo la activación del enlace deseado a través de un proceso conocido como HAT (Hydrogen Atom Transfer). La transformación procede a través de una reacción en cascada radicalaria/polar; así definida ya que el mecanismo puede ser segmentado en una etapa basada en química de radicales libres y una subsecuente con un comportamiento iónico más clásico.
Los autores afirman que, durante el estudio del alcance de la reacción, se encontró que ésta mostraba una gran tolerancia a diferentes grupos funcionales pudiendo extender la química a sustratos nunca vistos. Así, una amplia de gama de pirrolo-derivados con un diverso patrón de sustitución incluyendo grupos espacialmente voluminosos, electrodonadores y electroatractores, pudieron utilizarse para preparar los correspondientes productos con rendimientos generalmente buenos y excelente enantioselectividad. Además, se extendió este concepto al uso de diferentes heterociclos en los sustratos de partida, el uso de iminas no simétricas y la inserción de grupos potencialmente sensibles en condiciones drásticas de reacción, como aminas libres, enlaces dobles y triples, confirmando así las condiciones suaves del protocolo descrito.
El valor sintético de esta transformación quedó demostrado al efectuar una serie de transformaciones a los productos finales. La reducción de un enlace triple, la adición de un compuesto organomagnesiano al carbono imínico y la alquinilación del esqueleto de imidazol por acoplamiento cruzado de Sonogashira, refuerzan la atractiva plasticidad de los compuestos obtenidos. También, la inserción de un grupo altamente preciado dentro de la industria farmacéutica como el tiotrifluorometilo (SCF3) y la formación de un compuesto de coordinación con platino, son un valor añadido a la estrategia.
Referencia bibliográfica:
Rodríguez, R. I.; Mollari, L; Alemán, J. “A Light Driven Enantioselective Synthesis of Pyrroline Derivatives by a Radical/Polar Cascade Reaction” Angew. Chem. Int. Ed. DOI: 10.1002/anie.202013020.
Contacto:
José Alemán, Responsable del Grupo FRONCAT e Investigador responsable del Grupo FRUAM del Programa FotoArt-CM – jose.aleman@uam.es, www.uam.es/jose.aleman