![]()
Producción solar de combustibles líquidos a partir de la descomposición de CO2 y H2O a alta temperatura.
El empleo de energía solar de concentración para la producción eléctrica se postula como una opción tecnológica cada vez más importante en el panorama energético actual. Si además a partir de esta fuente renovable pueden obtenerse combustibles líquidos, como la gasolina o el diesel, nos encontraríamos ante una alternativa sostenible que podría ser capaz de sustituir a los combustibles convencionales, e incorporarse al sector del transporte, sin tener que llevar a cabo modificaciones en los motores actuales.
Autores: [Alicia Bayón Sandoval y Juan M. Coronado – IMDEA Energía]
La transformación de la energía solar concentrada en combustibles puede llevarse a cabo mediante los ciclos termoquímicos. Estos procesos consisten en el almacenamiento de la energía solar mediante el empleo de reacciones químicas sucesivas y complementarias que tienen lugar en un ciclo cerrado. Si del empleo de estas reacciones químicas se obtiene como producto un combustible, deben entrar en juego las especies químicas derivadas de la combustión de estos productos para poder cerrar el ciclo.
A partir de este concepto surge la producción de gas de síntesis (o “syngas”) descomponiendo simultáneamente agua y dióxido de carbono a alta temperatura. Este gas se trata de una mezcla de H2 y CO la cual puede ser transformada a hidrocarburos (como la gasolina) que pueden a su vez ser empleados en los motores de combustión interna produciendo de nuevo CO2 y H2O en el proceso de combustión. La Figura 1 muestra esquemáticamente este proceso:
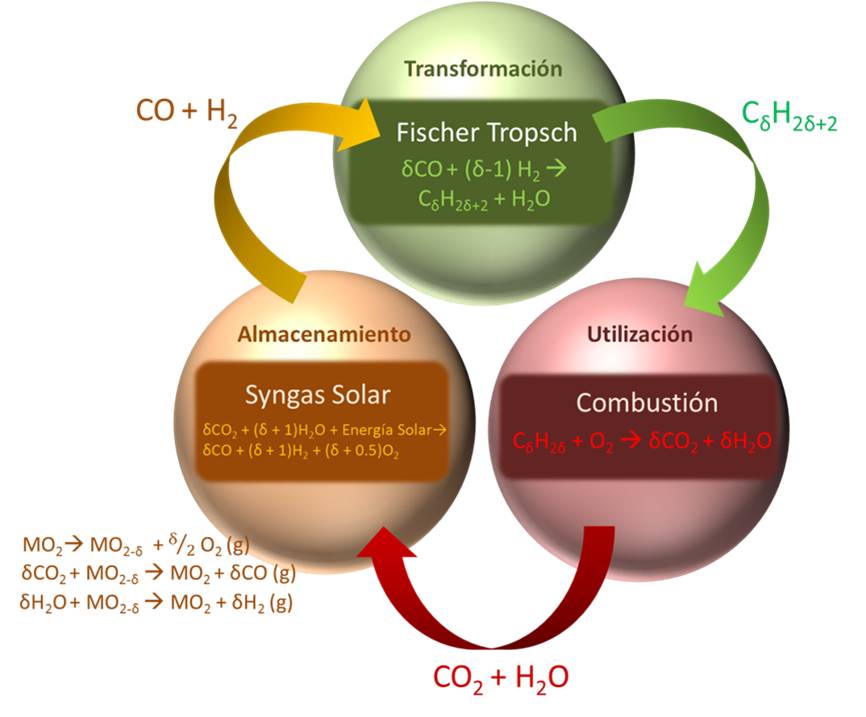
Figura 1: Esquema del global proceso de producción de hidrocarburos a partir de energía solar concentrada y su posterior aprovechamiento energético por combustión.
Como se observa en la Figura 1 el primer paso a llevar a cabo es el de la producción de gas de síntesis a partir de CO2 y H2O (Reacciones 2 y 3) realizándose el almacenamiento de la energía solar los compuestos químicos. Este paso requiere del empleo de un óxido metálico el cual en su estado más reducido es capaz de descomponer ambos reactivos, generándose la mezcla de H2 y CO en la proporción que más adecuada para la posterior síntesis de combustibles líquidos. El metal una vez es empleado en la reacción debe regenerarse mediante su reducción como se observa en la Reacción 1:
– MO2 à MO2-δ + O2 (g) Reacción 1
– δH2O + MO2-δ à δH2 (g)+ MO2 Reacción 2
– δCO2 + MO2-δ à δCO (g)+ MO2 Reacción 3
En una segunda etapa se lleva a cabo la transformación de esta mezcla de hidrógeno y monóxido de carbono a hidrocarburos líquidos mediante el proceso de Fischer Tropsch. Este proceso consiste en reacciones de polimerización capaces de formar cadenas de hidrocarburos con una longitud determinada para poder formular gasolina o el diesel. Este proceso data de 1920 y fue inventado por los alemanes Franz Fischer y Hans Tropsch.
Por último el ciclo se cierra mediante la utilización de estos hidrocarburos para la obtención de energía mediante su combustión. Durante el proceso son devueltos a la atmósfera los reactivos principales del mismo: dióxido de carbono y agua, de igual forma que en el proceso de combustión de los combustibles fósiles convencionales.
Recientemente este tipo de procesos han sido objeto de estudio por varios investigadores europeos [1, 2]. En uno de ellos la investigación se centra en el proceso solar de producción de syngas (ver Figura 1), mediante el empleo de óxido de cerio (CeO2) como fase metálica para llevar a cabo las reacciones químicas análogamente al proceso general.
– CeO2 à CeO2-δ + O2 (g)
– δH2O (g) + CeO2-δ à δH2 (g)+ CeO2
– δCO2 (g) + CeO2-δ à δCO (g)+ CeO2
Además de estudio de los equilibrios redox descritos en estas ecuaciones se hace necesario el desarrollo de una tecnología solar capaz llevar a cabo las reacciones químicas. En este estudio se han realizado varias pruebas en un reactor solar, donde son simuladas las condiciones reales en las que podría implantarse el proceso. De los primeros resultados obtenidos hasta ahora se observa que en la mezcla de salida, la proporción de H2 y CO puede ser controlada en el rango de 0.24-2.4 dependiendo de la proporción de agua y dióxido de carbono que se introduzca en el reactor. Por otro lado también se ha observado la estabilidad en producción continuada de syngas, realizando el ciclo hasta 10 veces durante 8 horas sin perder actividad química y manteniendo, para una misma alimentación, una producción constante de gas de síntesis.
Este estudio demuestra por tanto la viabilidad a escala de laboratorio de un proceso el cual supone una nueva vía muy atractiva para la producción de combustibles renovables.
[1] P. Furler, J. R. Scheffe and A. Steinfeld. Syngas production by simultaneous splitting of H2O and CO2 via ceria redox reactions in a high-temperature solar reactor. Energy Environ. Sci., 2011. DOI: 10.1039/clee02620h.
[2] S. Abadanes, H. I. Vallafan-Vidales, CO2 and H2O conversion to solar fuels via two-step solar thermochemical looping using iron oxide redox pair. Chem. Eng. J., 2011. DOI:10.1016/j.cej.2011.09.124.


Es un artículo muy interesante.
Aunque no es nada nuevo (de hecho es algo que hacen de forma natural las plantas) sería una excelente noticia poder realizar un proceso similar de forma artificial.
Lo único que falta saber es la eficiencia del ciclo que, me temo, será muy baja.
Un saludo.