![]()
SPHERIUM BIOMED: UNA EMPRESA QUE AYUDA A ATRAVESAR EL VALLE DE LA MUERTE DE LAS PATENTES
El pasado 24 de junio, tuvimos la suerte de disfrutar de una nueva sesión de los llamados “encuentros con los otros”, en los que los examinadores de patentes de la Oficina Española de Patentes y Marcas (OEPM) tienen la oportunidad de compartir impresiones con profesionales que conocen el mundo de las patentes, pero desde el otro lado.
En esta ocasión se trató de Jorge Alemany, de la empresa “Spherium Biomed”. Jorge es el director de la Oficina de Madrid, licenciado en medicina, con un doctorado en biología molecular y un MBA. Todos los integrantes del equipo de “Spherium biomed” proceden del mundo de la industria y de la investigación básica.
El objetivo de la empresa es poner en valor lo que se obtiene como fruto de la investigación básica en organismos públicos como universidades y hospitales universitarios.
Algunas grandes empresas farmacéuticas están cerrando sus centros de investigación y se están dirigiendo a lo que se conoce como “open innovation”.
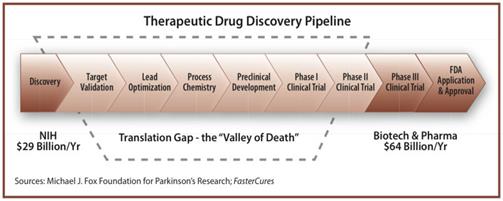
Es ahí donde “Spherium Biomed” interviene: detectan proyectos interesantes en organismos públicos, los estudian, los licencian, invierten en ellos durante unos 2 años y si merecen la pena, se los venden a las grandes empresas farmacéuticas, que realizan el desarrollo, con los ensayos clínicos. Hay una fase llamada “pre-clínica” que consiste en comprobar que el producto no es tóxico. Cuesta entre uno y un millón y medio de euros y añade poco valor.
La financiación, la obtienen a partir de los “Laboratorios Ferrer”, con el que tienen una “joint-venture”. Son accionistas y próximamente van a ser mayoritarios en el accionariado.
“Spherium Biomed” interviene en lo que dentro del mundo de la investigación se conoce como “el valle de la muerte”; lo que se encuentra entre la investigación básica y la comercialización.
Aunque han trabajado en el ámbito de los dispositivos médicos, han preferido centrarse en los productos farmacéuticos, donde encajan mejor. En el caso de los dispositivos médicos, la industria se encuentra muy cerca de la “academia”, de los médicos y cirujanos y se trata de una innovación muy incremental.
Su nivel de inversión para tratar de superar ese “valle de la muerte” oscila entre el medio millón y el millón de euros. Para que la empresa invierta en un proyecto, es fundamental que haya alguna patente. Actualmente trabajan en unos 11 proyectos, de los cuales hay 2 o 3 en fase clínica. La mayoría tienen su origen en España.
Un tipo de proyecto muy atractivo es el de “reposicionamiento”, similar al “segundo uso médico”. Es muy interesante porque se ha superado ya la fase clínica y se entra directamente en la fase de ensayo clínico. La mayoría de esos proyectos proceden de hospitales.
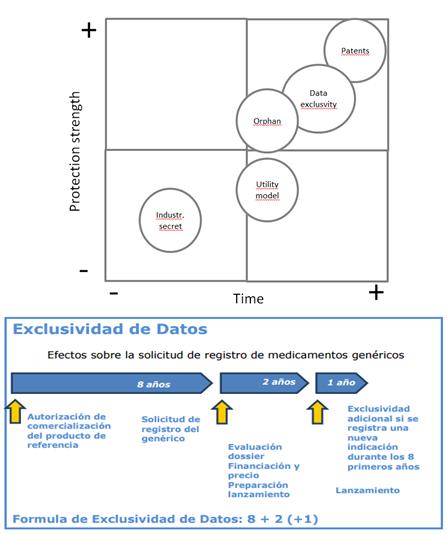
En relación con la “exclusividad de los datos”, es muy conocida la expresión denominada “8+2+1”. En aplicación de la Directiva 27/2004/EC y la LGURMPS (Ley de Garantías y Uso Racional de los Medicamentos y Productos sanitarios de julio de 2006), las compañías de genéricos pueden solicitar una autorización de comercialización basada en la bioequivalencia, únicamente cuando el período de 8 años de exclusividad de datos ha vencido y puede comercializarlo dos años después. El período efectivo de exclusividad es, por lo tanto, 10 u 11 años. El año adicional es aplicable cuando se añaden nuevas indicaciones al medicamento de referencia (que aportan un beneficio clínico significativo), durante el período de los ocho primeros años de comercialización del producto.
La duración de las patentes de 20 años desde la fecha de presentación no se considera suficiente para rentabilizar las inversiones en I+D, incluso si se suman los CCP’s (Certificados Complementarios de Protección).
Jorge Alemany también comentó que en el mundo de la investigación hay mucha presión por patentar antes de publicar. Como consecuencia, se dan casos donde se patenta antes de tiempo. Algunas Oficinas de Transferencia del extranjero, especialmente en Israel como Yissum, no patentan hasta que no tienen acordada la licencia y es preciso hacer mucho esfuerzo por contener al investigador, normalmente ávido por publicar.
Un problema con el que se enfrentan viene dado por el hecho de que ciertas OTRIS (Oficinas de Transferencia) se ponen en contacto con ellos cuando sólo quedan unos 3 meses para entrar en la fase nacional del PCT (Tratado de Cooperación en materia de patentes) y no es posible estudiar un proyecto en condiciones con menos de 6 meses disponibles.
También les ha resultado sorprendente descubrir que en ciertos casos el investigador no había llevado a cabo una búsqueda previa del estado de la técnica.
Otro aspecto interesante mencionado es que en ocasiones resulta conveniente sustituir el código con el que se suele designar a los productos por un nombre más comercial, que haga referencia a la indicación de dicho producto.
Un ejemplo es el de la marca Mucomel, registrada para un producto que contiene melatonina y que se emplea para tratar la mucositis causada por la radiación utilizada para el tratamiento de ciertos cánceres.
Jorge Alemany reflexionó sobre el coste de las patentes, que en su opinión no es elevado. Según su parecer, se presta una excesiva atención al número de solicitudes de patentes presentadas, cuando una patente sólo tiene valor si se vende y se explota. Un indicador más real de la situación de la innovación en un país es el número de patentes que se transfieren a la industria.
En su opinión, en la universidad española aún no hay una convicción de la necesidad de transferir el resultado de la investigación básica. Asimismo, ha sido testigo de cómo las administraciones frenan la constitución de empresas a partir de los resultados de la investigación, por temas legales.
En cuanto a los estados que se consideran necesarios para la extensión de la patente, la clave está en Europa, los EE.UU. y Japón. En cuanto a China, aún existe la percepción de que hay poca protección de la propiedad industrial.