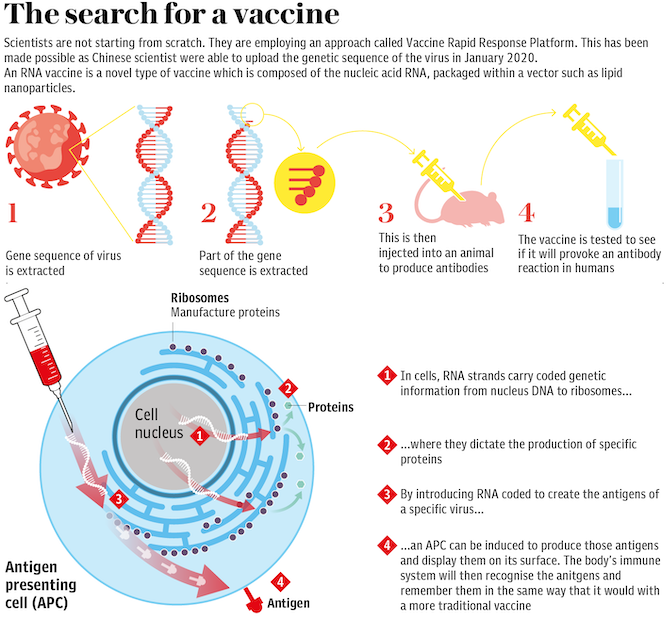
![]()
Coronavirus. Vacunas. Las prisas no son buenas.
Los principales científicos de todo el mundo afirman que acortar demasiados los plazos en el desarrollo de una vacuna contra el coronavirus para inocularla antes de fin de año es poco realista, inseguro e incluso «una locura». Un grupo de científicos publicó en la revista médica Lancet la semana pasada que una vacuna deficiente sería peor que no tener vacuna, sobre todo porque las personas que la tuvieran asumirían que ya no estaban en riesgo y dejarían de mantener la distancia. Las compañías farmacéuticas que compiten por producir vacunas frente Covid-19 se comprometieron a evitar atajos, ante la presión de lanzar la vacuna rápidamente al mercado. Las prisas no son buenas consejeras.
En situaciones normales, una vacuna tarda hasta diez años en desarrollarse, incluidos varios años de pruebas. Según los planes actuales delineados por políticos en el Reino Unido, Rusia y Estados Unidos, en este caso se ha reducido a menos de 12 meses.
A pesar de los informes de todo el mundo que sugieren que una vacuna podría estar lista en semanas, particularmente de los Estados Unidos, donde la «Operación Warp Speed» supuestamente tiene funcionarios esperando para distribuir la vacuna en octubre, antes de las elecciones presidenciales, los expertos están cada vez más preocupados de que el discurso oficial no se corresponde en modo alguno con los datos.
Ninguno de los principales candidatos a vacunas ha completado aún los ensayos clínicos, los organismos reguladores que autorizan las vacunas estudian con las necesidades que impone la epidemia de coronavirus y según los expertos no se han considerado cuestiones sobre la fabricación y distribución.
La Organización Mundial de la Salud no espera ver una vacuna hasta mediados de 2021, y está trabajando con expertos para definir los criterios para declarar que una vacuna tendría éxito.
En el articulo publicado en The Lancet, los científicos instaron a todos los reguladores a ceñirse a la guía de la OMS, que dice que no debe aprobarse ninguna vacuna con una eficacia inferior al 30%. Recomienda al menos un 50% de efectividad, pero permitiendo un 95% de precisión que podría significar un 30% en la práctica.
La FDA, el regulador de EE. UU., ha dicho que cumplirá con la referencia del 30%, pero algunos observadores creen que puede verse sometida a presión política para autorizar una vacuna que esté por debajo de ese umbral.
Al mismo tiempo, el jefe de la ‘Operación Warp Speed’ en los Estados Unidos, el Dr. Moncef Slaoui, respondió a las acusaciones de influencia política y declaró a la revista Science que renunciaría si hubiera una «interferencia indebida».
Se están desarrollando 321 candidatos a vacunas, algunas de las cuales usan tecnología totalmente nueva. Algunos de ellos se encuentran en la etapa final de ensayos, Fase III.
Esta etapa se inocula la vacuna en miles de personas para buscar posibles efectos secundarios, además de verificar que realmente funciona. Sin embargo, ninguno, incluido el candidato líder de la Universidad de Oxford, así como las candidatas de China, Alemania y EE. UU., han completado esta fase, y algunos aún están reclutando voluntarios. Se espera que se necesiten decenas de miles de personas en países de todo el mundo.
Y si la velocidad del desarrollo y las pruebas no tiene precedentes, la velocidad con la que los organismos reguladores y los gobiernos tendrán que evaluar la evidencia de las vacunas también lo es.
En una inusual declaración pública, varias empresas acordaron enviar las vacunas para su aprobación solo cuando se haya demostrado que son seguras y efectivas en estudios clínicos grandes. Los directores ejecutivos de nueve pioneros en el impulso de una vacuna contra el coronavirus firmaron el compromiso: AstraZeneca Plc, BioNTech SE, GlaxoSmithKline Plc, Johnson & Johnson, Merck & Co., Moderna Inc., Novavax Inc., Pfizer Inc. y Sanofi.
Los directivos afirman en la carta:
“Nosotros, las compañías biofarmacéuticas abajo firmantes, queremos dejar en claro nuestro compromiso continuo de desarrollar y probar vacunas potenciales para COVID-19 de acuerdo con altos estándares éticos y principios científicos sólidos.”
“La seguridad y eficacia de las vacunas, incluida cualquier vacuna potencial para COVID-19, es revisada y determinada por agencias reguladoras expertas en todo el mundo, como la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). La FDA ha establecido una guía clara para el desarrollo de vacunas COVID-19 y criterios claros para su posible autorización o aprobación en los EE. UU. La guía y los criterios de la FDA se basan en los principios científicos y médicos necesarios para demostrar claramente la seguridad y eficacia de las posibles vacunas COVID-19. Más específicamente, la agencia requiere que la evidencia científica para la aprobación regulatoria provenga de ensayos clínicos grandes, de alta calidad, aleatorizados y ciegos al observador, con la expectativa de estudios diseñados apropiadamente con un número significativo de participantes en diversas poblaciones.”
“Siguiendo la orientación de autoridades reguladoras expertas como la FDA con respecto al desarrollo de vacunas COVID-19, de acuerdo con los estándares y prácticas existentes, y en interés de la salud pública, nos comprometemos a:
– Hacer siempre de la seguridad y el bienestar de las personas vacunadas nuestra máxima prioridad.
– Continuar cumpliendo altos estándares científicos y éticos con respecto a la realización de ensayos clínicos y el rigor de los procesos de fabricación.
– Solo se enviará para aprobación o autorización de uso en caso de emergencia después de demostrar la seguridad y eficacia a través de un estudio clínico de Fase 3 que esté diseñado y realizado para cumplir con los requisitos de autoridades reguladoras expertas como la FDA.
– Trabajar para garantizar un suministro suficiente y una variedad de opciones de vacunas, incluidas las adecuadas para el acceso global.
«Creemos que este compromiso ayudará a garantizar la confianza del público en el riguroso proceso científico y normativo mediante el cual se evalúan las vacunas COVID-19 y, en última instancia, se pueden aprobar.»
Juntas, estas nueve empresas han desarrollado colectivamente más de 70 vacunas novedosas que han ayudado a erradicar algunas de las amenazas para la salud pública más complejas y mortales del mundo, lo que subraya su experiencia en el desarrollo clínico y el rigor regulatorio, así como sus compromisos de larga data con la seguridad del paciente y salud pública.
El documento tiene como objetivo contrarrestar las percepciones de que la presión política para vacunar lo antes posible puede comprometer su seguridad. El presidente de Estados Unidos, ha dicho que una vacuna podría estar lista antes de las elecciones presidenciales de noviembre y ha acusado a la FDA de ralentizar su trabajo para perjudicarlo políticamente.
La confianza pública en una vacuna será crucial a medida que las autoridades de salud pública intenten convencer a millones de personas sanas en todo el mundo para que la tomen. El compromiso también incluyó la promesa de que las empresas trabajarían para garantizar que haya opciones de vacunas «adecuadas para el acceso global».
Los fabricantes de medicamentos han acortado el cronograma de desarrollo de sus vacunas, normalmente es cuestión de años, a meses, y los primeros resultados de algunos de los pioneros se esperan antes de fin de año. Pfizer ha dicho que podría tener datos de prueba cruciales en octubre.
El compromiso no incluyó a Sinovac Biotech Ltd. de China o CanSino Biologics Inc. Rusia y China ya comenzaron a usar vacunas experimentales de forma limitada antes de que se completaran las pruebas en humanos.
La historia muestra que las cosas han salido mal, cuando se hicieron las cosas con prisas, incluso llegando a desencadenar efectos secundarios raros en la población en general.
Reuters
Fuentes