![]()
EL INFORME DEL PANEL DE ALTO NIVEL SOBRE EL ACCESO A MEDICAMENTOS DE NACIONES UNIDAS Y LAS PATENTES
El 19 de noviembre de 2015, el Secretario General de las Naciones Unidas Ban Ki-moon anunció la creación de un Panel de alto nivel sobre innovación y acceso a las tecnologías de la salud. El panel se encuentra presidido por la ex–presidenta de Suiza (Ruth Dreifus) y el ex–presidente de la República de Botswana (Festus Gontebanye Mogae) y su mandato es el de “revisar y evaluar propuestas, así como recomendar soluciones para remediar la incoherencia entre los derechos justos de los inventores, las leyes internacionales de derechos humanos, las normas comerciales y la salud pública en el contexto de las tecnologías de la salud”. Todo ello, en el contexto de la Agenda 2030 para el Desarrollo Sostenible.
La publicación de este informe se produjo el pasado 14 de septiembre de 2016 y desde su aparición ha provocado un pequeño “seísmo” en los organismos multilaterales en materia de salud pública y de propiedad intelectual e industrial (PI). Un ejemplo de esa repercusión viene constituido por las diferencias entre los delegados de los Estados participantes en el Comité Permanente de Derecho de Patentes de la OMPI respecto a cómo tratar este informe en las discusiones del Comité. Ésta fue la principal causa de desacuerdo que llevó a la falta de consenso que impidió la aprobación del “trabajo futuro” durante la vigesimoquinta sesión de dicho Comité. Ahora que se está aproximando la celebración de la vigesimosexta sesión del Comité, voy a tratar de analizar qué es lo que este informe dice sobre las patentes, y que tanto desacuerdo ha causado.
 La primera impresión que uno obtiene tras la lectura del informe es que todo gira alrededor del Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual e Industrial relacionados con el Comercio, ADPIC. Este Acuerdo proporciona a los países en vías de desarrollo y menos desarrollados, acceso a los mercados de los países más desarrollados a cambio de que en los primeros aumente el respecto a los derechos de PI y más concretamente a las patentes. Sin embargo, muchos de esos países con menor nivel de desarrollo se “arrepienten” de haber ratificado esos tratados, en los que se sienten los perdedores.
La primera impresión que uno obtiene tras la lectura del informe es que todo gira alrededor del Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual e Industrial relacionados con el Comercio, ADPIC. Este Acuerdo proporciona a los países en vías de desarrollo y menos desarrollados, acceso a los mercados de los países más desarrollados a cambio de que en los primeros aumente el respecto a los derechos de PI y más concretamente a las patentes. Sin embargo, muchos de esos países con menor nivel de desarrollo se “arrepienten” de haber ratificado esos tratados, en los que se sienten los perdedores.
El informe del panel parte de la premisa de que la obligación de respetar las patentes sobre tecnologías de la salud que impone el acuerdo sobre los ADPIC crea obstáculos para la consecución de los objetivos de salud pública de los estados miembros de la OMC (Organización Mundial del Comercio).
EL RESUMEN EJECUTIVO
En su informe ejecutivo, el informe reconoce la existencia dentro del acuerdo sobre los ADPIC de gran número de “flexibilidades” como, por ejemplo, la libertad para fijar los criterios de patentabilidad, determinando lo que se entiende por novedad, actividad inventiva y aplicación industrial, garantizando que las patentes sólo se concedan a una genuina innovación. Se afirma, asimismo, que son numerosos los gobiernos que no han hecho uso de estas flexibilidades, por motivos que van desde limitaciones de capacidad hasta presiones políticas y económicas por parte de otros estados e incluso compañías.
Además, añade que en los últimos años han proliferado acuerdos de libre comercio en los que se han incluido cláusulas relacionadas con la protección de la propiedad industrial y más concretamente con las patentes sobre tecnologías sanitarias que van más allá de lo establecido en los acuerdos sobre los ADPIC.
También dedica un apartado a la innovación tecnológica de financiación pública, con especial referencia a la Ley Bayh-Dole de los EE.UU. que en 1980 cambió profundamente el sistema de investigación pública permitiendo que las universidades obtuvieran patentes sobre invenciones obtenidas mediante financiación federal y las licenciaran a compañías privadas.
Dentro del campo de la información en materia de patentes recalca que en ocasiones, las decisiones sobre compras de medicamentos y fabricación de genéricos se ven retrasadas por la ausencia de una información precisa y actualizada sobre la situación legal de las patentes y más concretamente sobre qué patentes han caducado.
Concluye el informe del panel en su informe ejecutivo, que, bajo el modelo actual, la industria biomédica, con la ayuda de la propiedad industrial y la protección de datos, en adición a los beneficios de la financiación pública, recupera los costes de su I+D a través de precios elevados sobre productos protegidos mediante patente y mediante la exclusividad de datos. Como resultado, raramente se desarrollan nuevas tecnologías para enfermedades que no proporcionan ingresos elevados, como para infecciones bacterianas que se tratan mediante antibióticos.
LAS FLEXIBILIDADES DEL ADPIC
El informe del Panel recuerda las principales flexibilidades que proporciona el acuerdo sobre los ADPIC en relación con la protección mediante patentes:
Las importaciones paralelas (Art. 6)
Los productos puestos en un mercado extranjero se pueden importar sin necesidad de permiso del titular de la patente porque ya se ha producido el agotamiento del derecho.
Los criterios de patentabilidad
Los miembros de la OMC pueden desarrollar sus propias definiciones de novedad, actividad inventiva y aplicación industrial. También pueden negarse a conceder patentes sobre ciertas materias como, por ejemplo, plantas y animales.
El acuerdo sobre los ADPIC no define los criterios de patentabilidad, sólo establece que la invención debe ser nueva, implicar actividad inventiva y ser aplicable industrialmente o “útil”. Esto deja un amplio margen de maniobra a los gobiernos para definir y aplicar los criterios dentro de sus legislaciones nacionales. Según el informe del panel se pueden distinguir dos extremos: por un lado, las autoridades nacionales que no llevan a cabo examen sustantivo o que interpretan los requisitos de forma muy amplia, concediendo “patentes secundarias” que extienden la duración de la patente original, mediante la protección de métodos de uso, formulaciones, dosificaciones, etc. Y en el otro extremo estarían aquellas autoridades que establecen que el mero descubrimiento de una nueva forma o uso de una sustancia ya conocida no es patentable.
De acuerdo al panel, las llamadas “patentes secundarias” permiten el llamado “evergreening”, es decir se prolonga la exclusividad, se impide la entrada de productos genéricos y los precios permanecen altos, dificultando el acceso a los medicamentos. Asimismo, estas “patentes secundarias” introducen incertidumbre legal en el mercado, desincentivando la entrada de genéricos en el mercado por miedo a la infracción de alguna de esas patentes.
Sin embargo, reconoce el informe del Panel que estas “patentes secundarias” en ocasiones juegan un importante papel en el desarrollo de nuevas formas, más seguras y eficaces de medicamentos ya existentes.
Excepciones generales
Los miembros de la OMC pueden establecer excepciones a los derechos conferidos por la patente, siempre que esas excepciones no entren en conflicto de forma no razonable con una explotación normal de la patente y no vayan en perjuicio de los intereses legítimos del titular de la patente.
Licencias obligatorias
Para comprender lo que significan estas licencias, pueden visitar la siguiente entrada del blog.
Uso gubernamental
Una autoridad gubernamental puede decidir utilizar una patente sin permiso del titular con propósitos no comerciales y pagando una adecuada compensación teniendo en cuenta las circunstancias.
Provisiones relativas a la competencia
Los Estados Miembros pueden adoptar medidas apropiadas para evitar o remediar prácticas anti-competitivas en relación con la propiedad industrial, incluyendo licencias obligatorias.
Períodos de transición
Los países menos desarrollados no están obligados a proporcionar la protección mediante patente hasta el 1 de julio de 2021 y sobre productos farmacéuticos ni protección mediante patente ni de datos hasta el 1 de enero de 2033 o más tarde si se acuerda por parte de los Estados Miembros de la OMC.
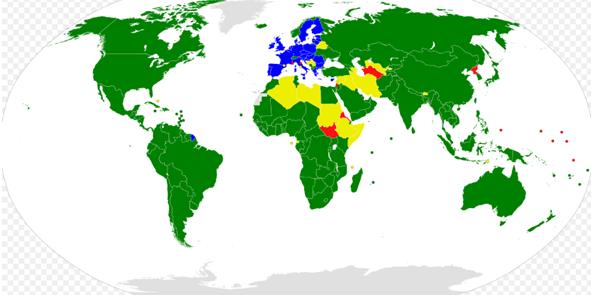
Estados miembros de la OMC: verde / Estados representados también por la Unión Europea: azul
Estados observadores: amarillo / Estados que no son miembros: rojo
Los Acuerdos de libre comercio
Sin embargo, afirma el panel que los Acuerdos de Libre Comercio que han proliferado en los últimos años limitan la utilización de esas flexibilidades. El informe del panel proporciona una serie de provisiones de estos Acuerdos de Libre Comercio que limitan las flexibilidades permitidas por el acuerdo sobre los ADPIC:
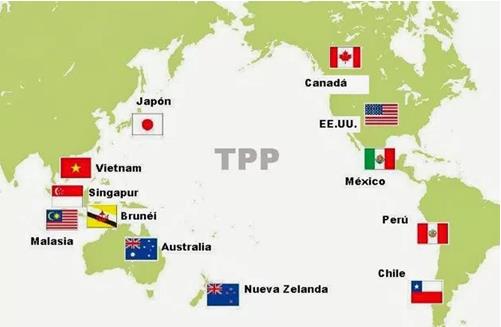
La patentabilidad de nuevos usos de un producto conocido: Acuerdo de Libre Comercio entre Corea y los EE.UU. Acuerdo entre Australia y los EE.UU, el TPP.
La prohibición de un procedimiento de oposición pre-concesión: Acuerdo entre los EE.UU. y Corea.
Periodos de exclusividad de datos clínicos (no se pueden utilizar los datos clínicos de la empresa innovadora para el lanzamiento de genéricos durante un período de tiempo): Acuerdos EE.UU.-Chile, EE.UU:-Marruecos, EE.UU. – Bahrain, Singapur-EE.UU., Australia-EE.UU.,TPP.
Extensión de la duración de la vida de la patente debido a retrasos no razonables en la autorización de comercialización o en la concesión de la patente: CAFTA, EE.UU., Bahrain, EE.UU.-Chile, EE.UU. -Singapur, EE.UU., – Australia, EE.UU., – Marruecos y TPP.
“Patent Linkage”: (Las autoridades sanitarias no pueden autorizar una versión genérica de un medicamento sobre el que existe una patente si no hay autorización del titular de la patente): EE.UU.,-Chile, EE.UU.,-Marruecos, EE.UU.,-Bahrain, TPP.
Límites en la concesión de licencias obligatorias (El uso de licencias obligatorias se limita a circunstancias muy específicas, como, por ejemplo, en el caso de prácticas anti-competitivas).
Límites a las importaciones paralelas: EE.UU.,-Marruecos, EE.UU.,-Australia, EE.UU.,-Singapur.
Observancia de los derechos de propiedad intelectual e industrial (medidas en relación con el control en la frontera, con procedimientos administrativos y civiles y la criminalización de ciertos casos de infracción de los derechos de PI más allá de lo que establecen los ADPIC’s): EE.UU.,-Vietnam, Japán-Indonesia, Japón-Malasia, Japón-Tailandia, EE.UU.,-Australia, EE.U.,-Laos, TPP.
En relación con el TPP, hay que recordar que tras la llegada a la presidencia de los EE.UU. de Donald Trump, su futuro se encuentra ahora en entredicho.
LAS LICENCIAS OBLIGATORIAS
En relación con este aspecto, el Panel no llegó a un consenso, pero urge a los Estados a redactar legislaciones nacionales que faciliten la autorización y uso de licencias obligatorias, incluyendo la remuneración al titular.
LAS LICENCIAS VOLUNTARIAS
El panel alaba en el informe el nivel de transparencia de los acuerdos logrados por al Medicines Patent Pool (MPP), donde todos los contratos se encuentran publicados.
LAS MARAÑAS DE PATENTES (PATENT THICKETS)
Según el informe, la aparición del acuerdo sobre los ADPIC supuso la adopción de nuevas estrategias de patentamiento. Entre ellas destacan las marañas de patentes o “patent thickets”, como se las denomina en inglés. Consiste en que las empresas “innovadoras” presentan múltiples solicitudes sobre una misma invención, lo cual crea un conjunto de derechos de patente que se solapan. Aquellos que pretenden lanzar un producto genérico deben obtener permiso sobre múltiples patentes. El informe cita que, en 2011, un análisis de “Libertad para operar” (Freedom to opérate) en relación con el retroviral ritonavir mostró que se encontraba protegido por 805 patentes.
Los informes parecen indican, según el panel, que estas “marañas de patentes” tienen una serie de efectos:
– Se desincentiva a terceros de llevar a cabo investigaciones sobre productos que podrían infringir ese conjunto de patentes.
– Alto coste de las licencias.
– Necesidad de pagar múltiples royalties si se quiere explotar un producto.
De acuerdo al panel, los gobiernos deberían adoptar estrategias para evitar esta práctica.
RECOMENDACIONES EN RELACIÓN CON LAS PATENTES
Las flexibilidades del TRIPS-ADPIC y las provisiones adicionales.
En relación con este aspecto, el panel recomienda que los miembros de la OMC hagan uso en su totalidad de las posibilidades permitidas por el Artículo 27 de los ADPIC para adoptar y aplicar definiciones rigurosas de lo que es una invención y de la patentabilidad, que favorezcan la salud pública de sus ciudadanos. Ello incluye la modificación de las legislaciones para limitar el “evergreening” (extensión de la vida) de las patentes y la concesión de patentes únicamente sobre invenciones que realmente lo ameritan.
En ese sentido, se afirma que tanto la UNCTAD, como el UNDP como la OMC y la OMPI deberían cooperar para apoyar a los gobiernos en la aplicación de criterios de patentabilidad sensibles a las necesidades de la salud pública.
También recomienda el panel que las organizaciones multilaterales deberían fortalecer las capacidades de los examinadores de patentes a nivel nacional y regional para aplicar estándares de patentabilidad rigurosos que tengan en cuenta dichas necesidades de la salud pública.
La investigación de financiación pública
Recomienda el panel que las universidades y centros de investigación que reciben financiación pública deberían priorizar los objetivos de salud sobre los beneficios económicos en sus prácticas relacionadas con las patentes y las licencias. Entre ellas prácticas recomendadas se incluyen la publicación, las licencias no exclusivas, las donaciones de la propiedad industrial y la participación en pools de patentes, entre otros.
Información sobre patentes
Los gobiernos deberían elaborar y mantener bases de datos con la situación legal de patentes sobre medicamentos y vacunas. Dicha información debería actualizarse de forma periódica por parte de la OMPI en colaboración con los usuarios para desarrollar una base de datos internacional y de búsqueda fácil que debería incluir:
– Los datos de las Denominaciones Comunes Internacionales (DCI’s) conocidas en el momento de presentación de la solicitud o posteriormente a la concesión de la patente y las fechas de concesión y de caducidad.
REACCIONES AL INFORME
Las reacciones al informe fueron de acogida entre aquellas organizaciones que trabajan en el ámbito de la salud, desde el punto de vista de la asistencia y sin ánimo de lucro, como “médicos sin fronteras” u “oxfam”, aunque manifestaron que se podría haber llegado más lejos. Las reacciones de la industria farmacéutica fueron de total rechazo. La IFPMA (International Federation of Pharmaceutical Manufacturers & Associations) consideró el informe una oportunidad perdida de dirigirse a las necesidades reales de los pacientes, que había adoptado un enfoque muy limitado e ignorado los obstáculos más comunes al acceso a los medicamentos. La Cámara de Comercio de los EE.UU. (U.S. Chamber) también denunció lo limitado del informe, que claramente había señalado a las patentes como las principales culpables de los problemas en el acceso a los medicamentos.
Entre los contrarios al informe del panel se recalca que éste no ha sido apoyado por ninguna agencia ni ninguna organización de las Naciones Unidas y que ni siquiera se alcanzó el consenso entre los miembros del panel a la hora de redactar las recomendaciones.
Por lo que se refiere a España, el grupo parlamentario Unidos Podemos ha presentado la proposición no de Ley 161/001810 en la Comisión de Sanidad y Servicios Sociales, donde se solicita al gobierno lo siguiente:
– Que se trabaje en las recomendaciones del informe.
– Que se incorpore dicho informe a la agenda política, y a las diferentes políticas públicas.
– Que se haga público el apoyo de España a este informe en las instituciones supranacionales en las que se debata este tema.
– Que se dé traslado de las recomendaciones a todos los Ministerios implicados y competentes.
– Que se dé informe a la comisión de los avances en ese proceso.
Parece que la proposición aún no ha sido debatida. Por cierto, si quieren conocer otros puntos de vista en relación con los factores que dificultan el acceso a los medicamentos, les recomiendo que visiten dos entradas del blog dedicadas a una serie de conferencias que se dieron en el Comité Permanente de Derecho de Patentes de la OMPI: (La relación entre los sistemas de patentes y la disponibilidad de los medicamentos (I) y (II)).
CONCLUSIÓN
De la lectura del informe se deduce que, aun cuando es cierto que se reconoce que hay otras barreras al acceso a los medicamentos, como ineficiencias regulatorias, una educación sanitaria deficiente, la falta de seguro médico o de suficiente protección financiera, el grueso del contenido del informe así como las recomendaciones del panel, se centran en las patentes, que aparecen así como las principales culpables de los problemas a los que el mundo se enfrenta en relación con el acceso a los medicamentos y en ese sentido es comprensible la reacción de rechazo que el informe ha generado en aquellos sectores que consideran que la figura de la patente es una herramienta fundamental para la innovación en el ámbito sanitario.

Es inútil la buena intención de bajar los costos del patentamiento de fármacos si no se entiende qué es una patente. Esta es la situación real, más si hablamos de patentes biotecnológicas. Desde hace 34 años, empezando con Reagan, se ha pretendido poner límites a los abusos, sin resultado.
[…] acontecimiento que ha supuesto un antes y un después dentro de esta guerra de desgaste ha sido el informe del panel de alto nivel sobre Acceso a medicamentos de Naciones Unidas, publicado el 14 de septiembre de 2016. Son numerosas las recomendaciones realizadas en relación […]
[…] como una herramienta legítima destinada a recuperar lo invertido en innovación. Sin embargo, en el informe del Panel de Alto Nivel de acceso a los medicamentos de las Naciones Unidas, se afirma que las “marañas de patentes” tienen una serie de efectos negativos sobre el acceso […]
[…] Por último, señalar que muchas de las cuestiones del documento son materia del informe del panel de alto nivel de la ONU sobre el acceso a los medicamentos. […]