![]()
LA MARAÑA DE PATENTES COMO ESTRATEGIA EN LA EMPRESA FARMACÉUTICA INNOVADORA
En esta entrada al blog vamos a hablar, para ilustrar este tema, sobre el caso del medicamento “adalimumab”, que es un anticuerpo monoclonal, anti-TNF, un medicamento de los denominados biológicos, de nombre comercial Humira, comercializado por la empresa AbbVie y que se emplea en el tratamiento de enfermedades autoinmunes como la artritis reumatoide, la psoriasis y la Enfermedad de Crohn.
Se trata de un medicamento muy eficaz, que permite llevar una vida normal durante largos períodos de tiempo a millones de personas afectadas por estas enfermedades, aunque con un coste anual en los EE. UU de 50.000 dólares por persona y año y en España de alrededor de 14.000 euros anuales.
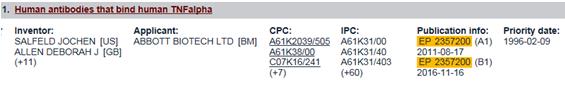
La patente que protege al adalimumab en Europa, la EP2357200, incluyendo su certificado suplementario de protección, caduca en 2018. En EE.UU acaba de caducar.
Dado que se trata de un medicamento de tipo “blockbuster”, es decir, un gran éxito de ventas, los titulares han presentado solicitudes sobre otros aspectos, como la dosificación, que han sido concedidas por la Oficina Europea de Patentes, en un intento de “prolongar” la protección de la patente.
Hay dos patentes europeas: EP2940044 y EP1944322 que protegen dosificaciones de la administración de adalimumab. En concreto, la EP2940044 tiene por objeto la administración de adalimumab en dosis de 40 mg. en semanas alternas conjuntamente con metotrexato para el tratamiento de ciertas enfermedades autoinmunes, como la psoriasis, la artritis reumatoide o la enfermedad de Crohn. Por otro lado, la EP1944322 protege la administración de adalimumab en 40 mg. en semanas alternas para el tratamiento de psoriasis.
Las patentes sobre dosificación de un determinado medicamento generan mucha controversia. Por un lado, los solicitantes de dichas patentes afirman que determinar la dosis exacta del medicamento más adecuada supone investigación, incluyendo un estudio de los efectos secundarios. Para otros, no es otra cosa que una herramienta de “evergreening” destinada a aumentar la vida legal de la patente y muy cercana a un método de tratamiento. En Europa, durante unos años la situación fue confusa, hasta que se publicó la decisión G2/08, que dice:
Question 1: Where it is already known to use a medicament to treat an illness, Article 54(5) EPC does not exclude that this medicament be patented for use in a different treatment by therapy of the same illness.
Question 2: Such patenting is also not excluded where a dosage regime is the only feature claimed which is not comprised in the state of the art.
En la decisión se reconoce que estas patentes pueden utilizarse para alargar la vida de la patente y resalta la importancia de una adecuada evaluación de la novedad y la actividad inventiva del objeto de las mismas.
Y la pregunta es…
¿pueden las empresas lanzar ya biosimilares del adalimumab?
Resulta complicado el lanzamiento de medicamentos “biosimilares”, que serían el equivalente a los “genéricos” en los medicamentos tradicionales, una vez caducan las patentes pertinentes: mayores inversiones y conocimientos técnicos que hacen que la industria de los biosimilares se asemeje más a la de las empresas innovadoras que a las de genéricos. Estas empresas se encuentran en países más avanzados tecnológicamente que los que se especializan en los llamados “genéricos”.
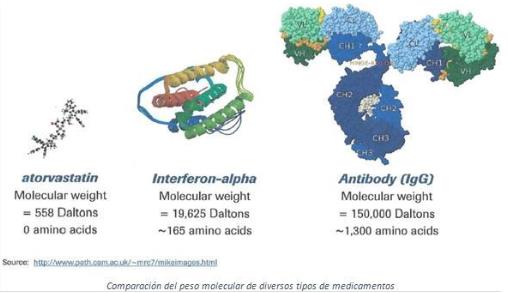
Los biosimilares son productos similares a los “originales”, pero a diferencia de lo que ocurre con los medicamentos tradicionales, donde se habla de genéricos, en este caso no son exactamente iguales. La fabricación de estos medicamentos biológicos, de gran peso molecular, es mucho más complicada, y la inversión necesaria para fabricar un “biosimilar” se recupera únicamente tras 10/12 años de explotación.
Las empresas Fujifilm y Samsung Bioepsis, que pretenden lanzar los biosimilares tan pronto como caduque la patente del adalimumab, se han acogido a una posibilidad que existe en el Reino unido y que se denomina “declaración Arrows”, que toma el nombre de un caso legal anterior, y donde se le solicita al tribunal que se pronuncie sobre si en la fecha de presentación de las solicitudes de patente en cuestión, una serie de dosificaciones del adalimumab tendrían novedad e implicarían actividad inventiva, y sobre si el lanzamiento de los biosimilares supondría una infracción de dichas dosificaciones.
Recientemente, la agencia Bloomberg ha publicado una nueva noticia en relación con este medicamento y sus patentes del que resaltamos lo siguiente:
Nos dice que “Humira” es actualmente el medicamento más vendido en el mundo, es decir, el número uno de los que se conocen como “blockbusters”. La primera de las patentes que lo protegen está a punto de caducar o ha caducado, dependiendo del estado, incluso teniendo en cuenta el período de extensión que conceden los certificados complementarios de protección. Afirma el artículo que a pesar de ello no se ha lanzado ningún biosimilar aún.
Según el autor del artículo, la principal razón para que no haya aparecido aún un biosimilar viene constituida por la “maraña de patentes” o “patent thicket” constituida por 100 patentes que protegen al medicamento, muchas de las cuales se presentaron en los últimos años. Se calcula que la protección podría extenderse hasta 2034. Dentro de esta llamada “maraña de patentes” se encontrarían las “patentes de dosificación” sobre las que hablábamos anteriormente.
La dirección de AbbVie defiende esta estrategia de patentamiento como una herramienta legítima destinada a recuperar lo invertido en innovación. Sin embargo, en el informe del Panel de Alto Nivel de acceso a los medicamentos de las Naciones Unidas, se afirma que las “marañas de patentes” tienen una serie de efectos negativos sobre el acceso a los medicamentos:
– Se desincentiva a terceros de llevar a cabo investigaciones sobre productos que podrían infringir ese conjunto de patentes.
– Aumenta el coste de las licencias.
– Obliga al pago de múltiples royalties si se quiere explotar un producto. (Por ejemplo, si en el caso del Adalimumab se habla de 100 patentes, serían 805 sobre el retroviral Ritonavir).
El Informe del panel recomienda a los gobiernos que desarrollen estrategias para evitar estas prácticas.
Para resaltar la protección extrema que la maraña de patentes confiere a AbbVie sobre su producto estrella, menciona el artículo que esta compañía ya ha presentado dos demandas en los EE. UU., contra dos empresas que pretenden lanzar biosimilares (Amgen y Boehringer Ingelheim GmbH), en el primero de los casos por la supuesta infracción de 61 patentes y en el segundo de 74.
¿Cuál es su opinión sobre esta estrategia de proteger una invención mediante una “maraña de patentes”?

[…] es la de obtener gran número de patentes secundarias, generando lo que se denomina una “maraña de patentes” y también a veces se conoce como […]
Nos alegramos de que te haya gustado la entrada. Un saludo
Muchas gracias por tu interés Marta. Te aclaro tus dudas:
Este medicamento se está comercializando prácticamente en todo el mundo, por tanto, claro que tiene autorización comercial en los EE. UU. y en Europa.
Respecto a la protección suplementaria, en España conocida como Certificado Complementario de Protección, sí que se ha concedido. La vida de las patentes es independiente en cada estado. Por ello, parece que en EE. UU. la patente ya ha caducado o está a punto de hacerlo.
Sin embargo, en España, aún está vigente la patente, una patente europea validada en España, de número de publicación ES2198552T3. Aunque esta patente caducó el 10/02/2017, se le ha concedido un certificado de protección complementaria, de número C200400004, que caducará el 01/03/2019. Hasta esa fecha el “Humira” estará protegido en España mediante patente.
Sin embargo, hay más patentes sobre el adalimumab en vigor en España, por ejemplo, nuevas formulaciones, excipientes, dosificaciones, etc . y la protección real mediante patente se extenderá durante más años sobre esos aspectos. Algunas de esas patentes son:
ES2431643 T3 (27.11.2013) AbbVie Biotechnology Ltd (100.0%)
Métodos para determinar la eficacia de adalimumab en sujetos que tienen espondilitis anquilosante utilizando CTX-II y MMP3 como biomarcadores
ES2535365 T3 (08.05.2015) ABBOTT BIOTECHNOLOGY LTD. (100.0%)
Tratamiento de trastornos relacionados con TNF alfa
ES2601202 T3 (14.02.2017) AbbVie Biotechnology Ltd (100.0%)
Formulaciones liquidas de anticuerpos anti-TNT-alfa de alta concentración
ES2611286 T3 (08.05.2017) ABBOTT BIOTECHNOLOGY LTD. (100.0%)
Régimen de dosis variables múltiples para el tratamiento de enfermedad de Crohn y colitis ulcerosa
Respecto a los “biosimilares” no son iguales a los medicamentos de “marca”, no son las mismas células, pero han demostrado en ensayos que tienen efectos “similares”. Te recomiendo que visites este enlace para conocer más sobre los “biosimilares”: https://www.osakidetza.euskadi.eus/contenidos/informacion/cevime_infac/es_cevime/adjuntos/INFAC_Vol_24_n_3_biosimilares.pdf
Un saludo
Valga el símil de cocina: con un caldo tan turbio, cuando hablamos de patentes, es necesario para aclarar, batir muchas claras de huevo como este artículo. Gracias por esta entrada tan cristalina.
En conclusión, el informe del Panel de Alto Nivel de acceso a los medicamentos de las Naciones Unidas, recomienda a los gobiernos que desarrollen estrategias para evitar estas prácticas, la cuestión es saber si los gobiernos estarán más preocupados por este informe o por la presión de ciertos lobbys.
Gracias de nuevo.
Muchas gracias por esta entrada. Me parece extremadamente interesante.
Me surgen algunas dudas:
Entiendo que este medicamento ha recibido autorización comercial al menos en EP y en US.
¿Este producto tiene concedido certificado de protección suplementaria al menos en EP y en US?
¿Este producto no estaría protegido por registro aunque haya expirado su patente?
Para hacer un biosimilar: ¿no tendrían que tener el mismo banco celular?. ¿Cómo demuestran que efectivamente es el mismo?
Muchas gracias de nuevo
Creo que se está explotando de manera injustificada el supuesto enorme esfuerzo de investigación que hay detrás de la obtención de nuevos medicamentos para extender de manera injustificada la protección conferida por la patente. Corresponde a la Unión Europea actuar para poner coto a estos abusos.