![]()
Avances en química básica: la dinámica de las reacciones químicas.
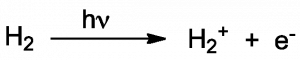
En la edición de la revista Nature del 10 de junio de 2010, se ha publicado un artículo describiendo la reacción de fotoionización de la molécula de hidrógeno. Este estudio ha combinado una aproximación experimental y computacional para describir con precisión el movimiento de los electrones en una reacción química. Para ello se han usado pulsos láser ultravioleta, de duración de 300-400 atosegundos, para promover la ionización de las moléculas de hidrógeno (H2) y de deuterio (D2). El artículo es una aportación muy importante al área de la dinámica química y es el fruto de la colaboración de 9 grupos internacionales, entre ellos, el de Fernando Martín del Departamento de Química de la Universidad Autónoma de Madrid. El profesor Martín explicó la investigación en una entrevista en A Hombros de Gigantes.
Una parte importante de la química física es el estudio de los mecanismos de reacción; lo que implica conocer el “camino” por el que los sustratos (materiales de partida, reactivos, reactantes) se convierten en los productos en una reacción química. Tiene tres aspectos relacionados a considerar:
1) La velocidad de reacción. Es decir, cómo de rápido los sustratos se convierten en productos. Normalmente, la velocidad de reacción es directamente proporcional a la concentración de los materiales de partida. La constante de proporcionalidad, denominada constante de velocidad o constante cinética (k), es la característica importante de una reacción química. El área de la química física que determina velocidades de reacción (experimentalmente) es la cinética química.
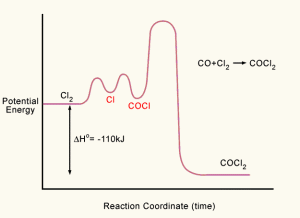
2) Energía. Conocer un mecanismo detallado de reacción implica conocer el contenido energético de cada una de las especies químicas. Muy pocas reacciones químicas transcurren en una única etapa y lo habitual es que los sustratos se conviertan en productos a través de varias especies químicas, denominadas intermedios de reacción, que normalmente suelen tener más energía (es decir, termodinámicamente menos estable) que los sustratos o productos. Cada conversión de sustrato en intermedio o de estos en productos transcurre a través de un máximo energético, que es el estado de transición de cada etapa elemental; la diferencia de energía entre cada intermedio y el máximo energético es la energía de activación (Ea) de la etapa elemental. La energía de activación de la reacción global es igual a la mayor energía de activación de las etapas elementales. Con las diversas etapas elementales e intermedios de reacción, el perfil de una reacción (la representación de la energía frente al progreso de la reacción) es un conjunto de montes y valles como se representa en la imagen siguiente.
Del sitio web.
La Ea es el parámetro termodinámico fundamental para determinar lo fácil o difícil que puede ser una reacción química. Arrenhius postuló que k depende exponencialmente del valor negativo de la energía de activación (Ea), dando lugar a la ecuación de Arrhenius, que ha sido suficientemente probada experimentalmente. Debido a la dependencia inversamente exponencial entre k y Ea, cuanto mayor es Ea, menor es la velocidad de reacción.
A partir de datos cinéticos a diversas temperaturas se puede determinar la energía de activación de una reacción química. Por métodos espectroscópicos o por cualquier medio indirecto (por ejemplo, “atrapándolos” en reacciones secundarias) se pueden identificar algunos intermedios (cuanto más estable, más fácil se detecta); pero es difícil determinar experimentalmente la existencia de todos los intermedios sintéticos de una reacción. En los últimos tiempos, la investigación de mecanismos de reacción ha recibido un impulso considerable de la química computacional, dónde no existe el “inconveniente” de la inestabilidad de una especie química para proceder a su estudio. En esta aproximación, se postulan posibles intermedios sintéticos y estados de transición de las etapas elementales; y se determinan computacionalmente sus energías y estructuras (geometrías: conectividades, distancias de enlace, ángulos de enlace y ángulos diedros). La metodología computacional permite decidir si la estructura propuesta como estado de transición es realmente un estado de transición y, además, se corresponde con la transformación propuesta.
3) Movimientos de los componentes del átomo. Para conocer el mecanismo de reacción detallado, es decir a nivel atómico, es necesario conocer el movimiento de los núcleos y de los electrones. Este era un reto considerado imposible de alcanzar experimentalmente, aunque el proceso se puede modelizar por métodos computacionales. Un avance considerable se consiguió cuando se usaron pulsos láser de duración ultracorta.
Cinética química experimental. El objetivo es determinar la variación de la concentración de sustratos o productos con el tiempo y ajustar los datos a alguna de las ecuaciones teóricas de la cinética química.
Muchas reacciones importantes, por ejemplo la reducción de nitrógeno a amoniaco ocurren muy lentamente, siendo necesaria la presencia de un catalizador; que es una especie química que no se consume en una reacción, pero que aumenta la velocidad de la misma. Por supuesto, aunque el catalizador no se consume en la reacción, sí participa en el mecanismo de la misma, generando intermedios de reacción que evolucionan regenerando el catalizador, que vuelve a comenzar el ciclo catalítico. Las cinéticas de estas reacciones “lentas” se pueden seguir con un cronómetro.
Con el objetivo de obtener datos de las etapas elementales de un mecanismo de reacción (o determinar la velocidad de una reacción muy rápida), dónde hay que determinar la variación de concentración de intermedios (que están presente en muy pequeñas concentraciones y con tiempos de vida, generalmente, muy cortos), fue necesario desarrollar métodos experimentales adecuados. Manfred Eigen (Premio Nobel en 1967) desarrolló métodos adecuados para medir la velocidad de reacciones en la escala de tiempo de los microsegundos (un microsegundo = 10-6 segundos). El método de relajación desarrollado por Eigen consiste en alterar un estado de equilibrio de una reacción química (suministrando energía de alguna manera) y midiendo el tiempo que tarda el sistema en volver a alcanzar el equilibrio.
Más recientemente, Ahmed Zewail (Premio Nobel en 1999) encontró que se podía usar un pulso láser de femtosegundos (un femtosegundo = 10-15 segundos) de duración para estudiar experimentalmente detalles y velocidades de reacciones a nivel atómico, siendo una técnica poderosa para seguir el movimiento de los núcleos en una molécula durante una reacción química.
Zewail anticipó que un pulso láser de duración de atosegundos (un atosegundo = 10-18 segundos) permitiría monitorizar el movimiento de los electrones durante una reacción química. Y esto es lo que han conseguido los autores del artículo en Nature, estudiando la reacciones de fotoionización de las moléculas de hidrógeno (H2) y de deuterio (D2), un isótopo del hidrógeno. Los resultados experimentales han sido completados con extensos cálculos mecano-cuánticos (realizados por el grupo de la UAM) para resolver la ecuación de Schrödinger dependiente del tiempo (la ecuación que describe el estado de un sistema cuántico, por ejemplo, un electrón), que ha llevado el uso de un superordenador durante muchos miles de hora, pues aunque el sistema solo tenga dos electrones, la resolución de dicha ecuación no es analítica debido al efecto de correlación electrónica (la interacción entre los dos electrones del sistema).
Este tipo de estudios supone un avance considerable en el estudio de las reacciones químicas, constituyendo un área de la química física, denominada dinámica química.

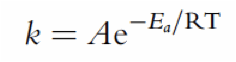
[…] Avances en química básica: la dinámica de las reacciones químicas http://www.madrimasd.org/blogs/quimicaysociedad/2010/06/18/131792 por galaxy hace 2 segundos […]
Espero que se encuentre bien antes que nada, le escribo solo para felicitarle por el buen contenido del blog, espero siga publicando sus interesantes temas, un saludo.
excelnete artículo, me gustaria ampliar el tema de las fases de transición
no hay lo q queria
no pasa nada!!!!!!!!!
Aunque es muy habitual el diagrama presentado en el texto, no he acabado de comprender nunca las abscisas. En concreto, ¿seguro que la coordenada de reacción tiene unidades de tiempo? ¿por qué en el texto se habla del progreso de la reacción y en la figura se cita la coordenada de reacción? y ¿por qué esas zonas planas antes de empezar la reacción y después de terminar la secuencia de reacciones? ¿Es que no hay «progreso» al principio?
Opino que aquí se arrastra una mala nomenclatura desde hace muchos años, generado por los libros de texto elementales, que confunde el mundo macroscópico con el microscópico, y que debería depurarse de una vez. Creo que en términos generales se confunden el progreso de la reacción (lo que eso sea), el «camino de reacción» («reaction path»), la coordenada de reacción -un parámetro geométrico más o menos complejo- y la conversión de la reacción.
Disculpas por esa intromisión de un no-químico físico.
Estimado Claudi,
Como siempre, tienes mucha razón.
El diagrama es una representación muy simplificada de la realidad. Lo que tendríamos que representar es una hipersuperficie de energía potencial; representando la energía frente a los grados de libertad y/o las coordenadas de todos los átomos de los sustratos y reactivos. Por supuesto, visualizar esta superficie multidimensional es muy difícil y comlicada de entender por estudiantes preuniversitarios.
Al poner el tiempo (que no es estrictamente correcto), estamos haciendo una representación simplificada del progreso de la reacción.
[…] http://www.madrimasd.org/blogs/quimicaysociedad/2010/06/18/131792 […]