![]()
Reservorio animal del MERS-coronavirus: el círculo se estrecha
Hace unas semanas publicamos un post sobre el nuevo coronavirus de Oriente Medio, conocido como MERS-Coronavirus (MERS-CoV) en el que ofrecíamos un resumen de la información disponible sobre este nuevo virus emergente en un formato de «Preguntas y respuestas«. Una de las preguntas era: «¿De donde ha salido? En ella reflejábamos lo siguiente:
El MERS-CoV es probablemente un virus adaptado a una especie animal cuya identidad desconocemos, que en los últimos tiempos ha podido transferir esporádicamente el virus a humanos con éxito. El modo cómo este virus se las ha apañado para conseguirlo es aún un misterio. Entre los expertos se da cierto crédito a la hipótesis de que la especie animal que actúa como huésped principal del MERS-CoV podría ser algún tipo de murciélago, pero habrá que investigar en profundidad para saberlo. Es importante determinar qué especie animal está actuando como reservorio epidemiológico porque eso ayudaría enormemente a prevenir y controlar la enfermedad. Es posible igualmente que existan especies que actúen como hospedadores intermedios entre el reservorio natural y el hombre. Un equipo internacional multidisciplinar trabaja a instancias del Ministerio de Salud Saudí, la Universidad de Columbia y la Alianza EcoHealth, para identificar las especies que podrían jugar un papel en la transmisión de este virus.
Pues bien, una parte de ese trabajo acaba de salir a la luz en forma de un interesante artículo en la revista Emerging Infectious Diseases (1). En él se describe un hallazgo muy relevante que puede arrojar luz sobre el origen del MERS-CoV: al analizar muestras de 96 murciélagos de 7 especies distintas, recogidas en un radio de 12 km alrededor de la casa del «caso índice» (primer caso identificado de enfermedad por este virus), en Bisha, Arabia Saudí, en octubre de 2012 y abril de 2013, han encontrado una secuencia de ARN idéntica a la del MERS-CoV en las heces de un único murciélago, de la especie Taphozous perforatus (Emballonuridae) o «murciélago de tumba egipcio» (ver Figura).
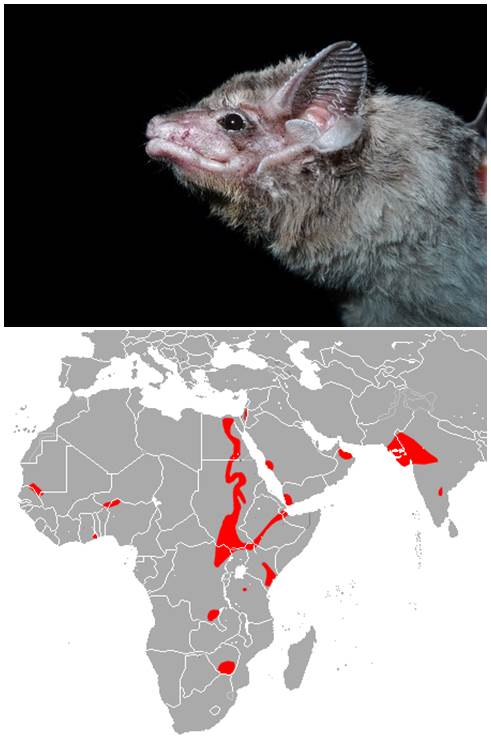
-Fuentes: iNaturalist (foto) y Wikipedia (mapa)-.
El Taphozous perforatus se refugia en edificios abandonados y se alimenta de insectos. Su hábitat natural es la sabana seca. Su distribución geográfica incluye no solo áreas de Oriente Medio sino también de África y del subcontinente Indio. El ejemplar en el que se identificó un fragmento de secuencia de ARN 100% idéntica al MERS-CoV fue capturado en un huerto de palmeras datileras que el paciente designado como «caso índice» tenía no muy lejos de su propia casa, dentro de una finca de su propiedad. La forma en que este hombre pudo infectarse es aún un misterio. Cabe la posibilidad de que el virus pase directamente del murciélago al ser humano, es decir, que el murciélago sea el reservorio epidemiológico del virus. Pero esto no es tan obvio, porque las dos especies no conviven tan estrechamente como para facilitar esa transmisión. Cabe imaginar que en determinados edificios habitados por estos quirópteros se refugien ocasionalmente personas que puedan llegar a infectarse al respirar el polvo de guano allí presente, de una forma parecida a lo que se supone que ocurre en determinadas cuevas africanas donde habitan los murciélagos que actúan como reservorio natural del virus Ébola. Pero también es posible que exista una especie animal que actúe de hospedador intermedio entre los murciélagos y el hombre, como ocurre por ejemplo con el virus SARS (un virus similar al MERS-CoV), y que se cree que utilizaba especies intermedias más cercanas al hombre, como la civeta (cuya carne es consumida en China), como hospedador intermedio entre los murciélagos que actúan como reservorio en la naturaleza, y el ser humano. También caben otras posibilidades, por ejemplo, que haya más de una especie animal que actúe como reservorio natural, o que el Taphozous perforatus no sea el reservorio principal, sino tan solo un hospedador accidental sin papel real en la transmisión del virus a humanos. Todo ello deberá investigarse concienzudamente.
En la misma finca donde se halló el murciélago con secuencias de MERS-CoV habitaban 4 dromedarios de los que el paciente «índice» era igualmente el propietario. Estos animales en una primera instancia fueron sospechosos de transmitir la enfermedad. El caso es que el papel de estos camélidos aún no está muy claro. Un estudio recientemente publicado ha mostrado anticuerpos «específicos» a MERS-CoV en el suero de cada uno de los 50 dromedarios examinados procedentes de Omán, y en un 14% de los 105 dromedarios de las Islas Canarias examinados (2), mientras que no se encontraron ese tipo de anticuerpos en otras especies ganaderas examinadas (ovejas, cabras, vacas), ni en camélidos americanos. Estos resultados hay que tomarlos como muy preliminares, ya que, como bien han señalado en sendas notas informativas la OIE y la FAO, las pruebas serológicas empleadas aún no están validadas para estos animales, y existe igualmente la posibilidad de que esos anticuerpos sean originados frente a un agente infeccioso similar pero no idéntico al MERS-CoV, que pueda causar lo que se conoce como «reacción cruzada» en los tests serológicos empleados en su detección. En cualquier caso, es importante determinar cual es el origen de esos anticuerpos en dromedarios, y sobre todo esclarecer si esta especie tiene algún papel en la transmisión del virus MERS-CoV.
El equipo multidisciplinar internacional que ha realizado este importante hallazgo del murciélago portador de secuencias del virus MERS, está en la actualidad trabajando en un estudio de campo que abarca un elevado número de muestras (se habla de más de 15.000 análisis) precedentes de un amplio rango de especies animales de las zonas afectadas, incluyendo dromedarios y otras especies domésticas, para determinar si el virus está también presente en las mismas. Estos estudios se han visto retrasados con respecto a los realizados en murciélagos, ya publicados, porque es preceptivo que las muestras de animales susceptibles a la fiebre aftosa (una grave enfermedad que afecta a mamíferos artiodáctilos, o de «pezuña hendida»), procedentes de países endémicos, sean previamente analizadas para determinar que están libres del virus de la fiebre aftosa. Estos análisis requieren laboratorios dotados de medidas de bioseguridad muy estrictas(estamos hablando del más alto nivel de biocontención para patógenos agroalimentarios, el nivel 4 de la OIE o equivalente). En EE.UU. existe un laboratorio de estas características en Plum Island (NY), perteneciente al Departamento de Agricultura de los EE.UU. (USDA), que es donde se están realizando estos análisis previos. A medida que se vayan conociendo los resultados de este estudio sistemático es previsible que se vaya reconstruyendo la epidemiología y la historia natural de esta enfermedad. Estaremos atentos a estos estudios.
NOTA (añadida el 29 de agosto): El Centro Europeo de Control de Enfermedades (ECDC) acaba de publicar en su página web una nota aclaratoria sobre los resultados de la publicación que hemos comentado en este post (1). En ella aluden a ciertas limitaciones técnicas de ese trabajo, que afectarían a la conclusión principal del mismo. Es recomendable leer los detalles (la nota está en inglés), pero cabe destacar que es cierto que una única reacción de PCR positiva (de 8 intentadas con cada muestra) es poco y que la secuencia obtenida es muy corta (alrededor de 200 nucleótidos) para afirmar tan rotundamente que pertenece a un virus «idéntico al MERS-CoV». El tema del posible origen zoonótico del MERS-CoV se ha puesto muy interesante, y habrá que esperar la confirmación con otra(s) técnicas para ver si estos resultados se consolidan.
Referencias:
(1) Memish ZA, Mishra N, Olival KJ, Fagbo SF, Kapoor V, Epstein JH, et al. Middle East respiratory syndrome coronavirus in bats, Saudi Arabia. Emerg Infect Dis [Internet]. 2013 Nov [date cited]. http://dx.doi.org/10.3201/eid1911.131172
(2) Reusken et al Middle East respiratory syndrome coronavirus neutralising serum antibodies in dromedary camels: a comparative serological study The Lancet Infectious Diseases – 9 August 2013 doi:10.1016/S1473-3099(13)70164-6

[…] == "undefined"){ addthis_share = [];}TweetLos seguidores de este blog ya saben (véase post del 28 de agosto de 2013) que uno de los puntos más intrigantes en la investigación sobre la actual epidemia de […]