![]()
Las aves como reservorios de virus zoonóticos
En el último número de la revista «Virología» publiqué un artículo titulado «Las aves como reservorio de virus zoonóticos» que, por el interés que creo que puede tener para los lectores de este blog, y con permiso de los editores de la revista, reproduzco a continuación.
(NOTA: Si vas a reproducir todo o parte de este artículo, por favor cita la fuente. Gracias).
Las aves como reservorios de virus zoonóticos
Resumen
Las aves forman parte de nuestro entorno. De la pléyade de virus que afectan a las aves, solo una pequeña parte son zoonóticos, es decir, pueden infectar y causar enfermedad en la especie humana. De entre ellos destacan dos grupos: el primero es el de los virus de la gripe o influenza aviar, transmitidos fundamentalmente por la vía aerógena; y el segundo está constituido por ciertos arbovirus (virus transmitidos por picaduras de artrópodos) pertenecientes a las familias Flaviviridae (género Flavivirus) y Togaviridae (género Alphavirus), que engloban patógenos humanos importantes como el virus West Nile, el virus de la encefalitis japonesa, el virus Sindbis o el virus de la encefalitis equina del Este. Muchos de estos virus zoonóticos con reservorio aviar han causado episodios de emergencia recientemente, como el caso de la influenza aviar de los subtipos H5N1 y H7N9, ambos originados en Asia, o el virus West Nile, el cual en las dos últimas décadas ha alcanzado una distribución mundial, siendo actualmente considerado el arbovirus más extendido sobre la Tierra. Estos dos casos ponen de manifiesto el potencial de los virus zoonóticos con reservorio aviar para dar lugar a alertas sanitarias de importancia en salud pública.
Introducción
Las aves forman parte de nuestros ecosistemas naturales, de nuestro entorno Los seres humanos hemos domesticado algunas especies de aves para hacer de ellas una valiosa fuente de alimento. Ciertas aves son apreciadas como animales de compañía, y las hay que son protagonistas de diferentes formas de ocio, especialmente la caza, ya sea como valiosas piezas a cobrar o al revés, cazando para nosotros, como por ejemplo en la cetrería. En algunos casos las hemos adiestrado para utilizarlas en tareas específicas, como las palomas mensajeras. Sus plumas nos han servido como instrumentos de escritura y ornamento, y aún son muy utilizadas para confeccionar almohadas y edredones más mullidos y ropa de abrigo ligera y aislante del frío. Fascinados por la rica variedad de plumajes, colorido y belleza, las colecciones zoológicas de aves han atraído nuestra atención desde siglos, y han inspirado innumerables obras artísticas. Esta admiración ha evolucionado hoy día en una creciente afición por observar aves en su entorno natural, y los viajes y excursiones ornitológicas son ya una opción turística de importancia en algunas zonas. Tales son algunos de los variados y múltiples tipos de relación que mantenemos con las aves.

Como todos los demás seres vivos sin excepción, las aves son susceptibles de infección por un amplio rango de virus, lo cual es natural y no nos debe llamar la atención. Sin embargo, recientes crisis sanitarias, pero muy en particular la emergencia del virus de la influenza o gripe[a] aviar H5N1 acaecida a principios de este siglo, que tuvo su momento álgido en 2006 (2), han supuesto un punto y aparte en nuestra relación con estos hermosos seres que son las aves. Este artículo pretende dar una somera idea de qué tipos de virus, de entre los que podemos encontrar en las aves, suponen algún riesgo para la salud pública
Virus aviares y zoonosis
En primer lugar hay que decir que los humanos no compartimos muchos virus patógenos con las aves. Esto se debe en parte a que entre ambos existe una gran distancia evolutiva (los linajes de mamíferos y aves divergieron hace unos 300 millones de años), de modo que el salto desde las aves a los humanos no es ya de especie, sino de clase, varios taxones por encima, y por tanto más difícil. Pero también contribuyen a ello importantes diferencias fisiológicas, y en particular el hecho de que las aves poseen una mayor temperatura corporal en comparación con la nuestra, lo cual agrega dificultad a ese salto. También hay que señalar que las aves poseen un excelente sistema inmunológico, con un intenso desarrollo de la inmunidad innata (3), especialmente útil en la defensa frente a las infecciones víricas, lo cual redunda en que esa dificultad sea aún mayor.
Como consecuencia de ello, cabe decir que de entre la pléyade de virus que se han especializado en la infección de diferentes tipos de aves, que sería prolijo detallar aquí[b], tan solo unos pocos virus son claramente zoonóticos, y éstos pertenecen a un número limitado de familias víricas, fundamentalmente tres: Orthomyxoviridae (virus de la influenza o gripe aviar), Flaviviridae (fundamentalmente los virus encefalíticos del género Flavivirus) y Togaviridae (ciertos patógenos del género Alphavirus). Se da la circunstancia de que, mientras que los primeros, los virus de la influenza o gripe aviar, se transmiten fundamentalmente por la vía aerógena (vías respiratorias), los flavivirus y alfavirus zoonóticos aviares se transmiten por medio de la picadura de vectores artrópodos (mosquitos y garrapatas, fundamentalmente), es decir, son arbovirus (de la contracción en inglés de “arthropod-borne virus”), y las zoonosis que causan son arbozoonosis (arthorpod-borne zoonoses”). De todos ellos, los más ampliamente distribuidos son los virus de la influenza aviar y los flavivirus zoonóticos, en particular algunos como el virus West Nile (en adelante, WNV), cuya distribución alcanza todos los continentes habitados de la Tierra[c]. Por este motivo y porque han protagonizado episodios importantes de emergencia y/o reemergencia en tiempos recientes, este artículo se centrará en estos dos tipos de virus zoonóticos con reservorio aviar.
La influenza aviar como zoonosis
De entre los 3 géneros conocidos de virus de la influenza, o virus gripales (familia Orthomyxoviridae), solamente uno (influenzavirus A) incluye virus zoonóticos aviares, por lo que en este artículo nos ceñiremos únicamente a éstos. Los influenzavirus A son los causantes de la “gripe A”, que engloba un rango de patógenos causantes principalmente de la gripe aviar, aunque, como se verá más adelante, un cierto número de ellos han ido evolucionando y adaptándose a determinadas especies de mamíferos, generando virus de las gripes porcina, humana y equina, entre otros
Los virus de la gripe A son marcadamente variables y heterogéneos. El aspecto más conocido de esta diversidad lo constituyen sus subtipos antigénicos. Éstos vienen determinados según la particular composición de las dos glicoproteínas de membrana que exhiben en su superficie, la hemaglutinina (HA) y la neuraminidasa (NA). En ellas residen importantes funciones como la unión a receptores celulares o los sitios principales de reconocimiento antigénico por parte del sistema inmunitario del hospedador. Se conocen dieciséis subtipos diferentes de HA (H1-H16) y nueve de NA (N1-N9)[d]. Estas dos glicoproteínas víricas se pueden presentar en cualquier combinación, lo que da lugar a 144 combinaciones o subtipos antigénicos posibles de virus influenza, distinguibles serológicamente. Cada subtipo tiene sólo una clase de antígeno HA y una clase de antígeno NA. Se denominan HxNy siendo x e y el subtipo de HA y NA, respectivamente, que poseen. Por ejemplo, H5N1 designa el virus influenza A que posee HA del subtipo H5 y NA del subtipo N1. Pero la variabilidad de los virus de la gripe A no se agota en los subtipos antigénicos, pues dentro de cada subtipo existe una considerable variabilidad genética, antigénica y fenotípica. Por otro lado, el virus posee otras 9-10 proteínas, cada una de las cuales es necesaria para distintas funciones relacionadas con el ciclo biológico del virus, y son codificadas en distintos segmentos del ARN vírico (4). Como estas proteínas también varían entre cepas del virus, resulta que al final la combinatoria de estos 11-12 elementos genera una variabilidad genética enorme en estos virus.
Toda esta variabilidad surge esencialmente de dos procesos, que dan lugar a dos fenómenos bien conocidos: 1) la “deriva antigénica” (“antigenic drift”) y 2) el “desplazamiento antigénico” (“antigenic shift”) de los virus de la gripe. El primero tiene lugar como consecuencia principalmente de la mutación y la selección que ocurre a nivel de cada segmento de ARN. La tasa de mutación de los virus de la gripe A es elevada (> 10-3 sustituciones por nucleótido por año (5)), lo cual supone una elevada capacidad para generar variantes en cada infección. A ello hay que añadir el proceso responsable del segundo fenómeno mencionado antes, el desplazamiento antigénico, que tiene lugar como consecuencia de una propiedad singular de algunos virus que, como los virus gripales, tienen el genoma segmentado: dos variantes diferentes del virus pueden intercambiar segmentos de su genoma al azar si se encuentran coinfectando al mismo individuo. Este fenómeno es conocido como “redistribución genética” (“genetic reassortment”) y ofrece a estos virus un mecanismo muy eficaz de “barajar genes”, generando combinaciones distintas que pueden igualmente probar su eficacia frente a la selección natural ejercida por el medio, que actúa de filtro, permitiendo que progresen solo aquellos virus adaptados funcionalmente a unas condiciones ambientales concretas que prevalecen en el medio al que se enfrentan.
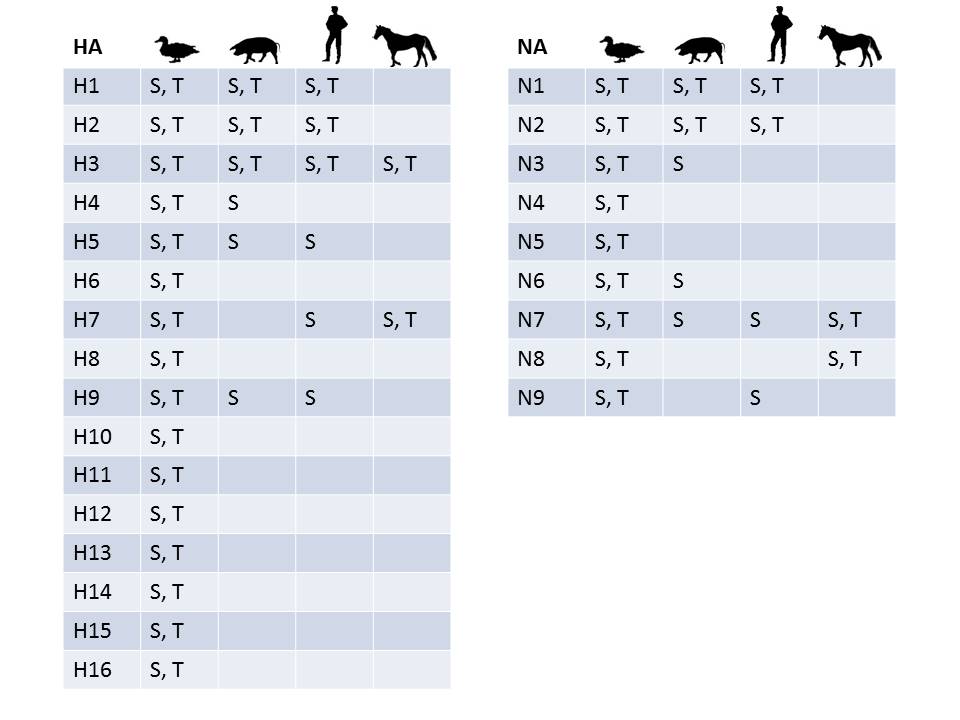
La enorme variabilidad que presentan los virus gripales ofrece una base para explicar por qué son unos de los pocos virus aviares con capacidad zoonótica. Hemos mencionado al principio las dificultades para superar con éxito la barrera fisiológica y evolutiva entre las aves y la especie humana. De hecho, superar esa barrera ha sido imposible hasta ahora para la mayoría de los virus de la gripe aviar. Sin embargo, unas pocas variantes la han podido cruzar con éxito, lo que indica que hay variantes con más posibilidades que otras para dar ese salto. Por ejemplo, de los 16 subtipos “H”, sólo 6 se encuentran en la especie humana, de los que 3 (H1-3) han conseguido adaptarse completamente a ésta (y por tanto ya no son “zoonosis”), y otros 3 (H5, H7 y H9) producen gripe A zoonótica, con casos esporádicos, sin transmisión entre humanos[e]. Para otras especies ocurre lo mismo. De igual manera, de los 9 subtipos “N” que se conocen en aves, solamente 2 (N1 y N2) se encuentran en los virus gripales que afectan comúnmente al hombre, y otros dos lo hacen en virus causantes de brotes esporádicos, como son el N7 (por ejemplo, brote de H7N7 en Holanda en 2003) y, recientemente el N9 (virus H7N9 de 2013 en China) (Figura 2).
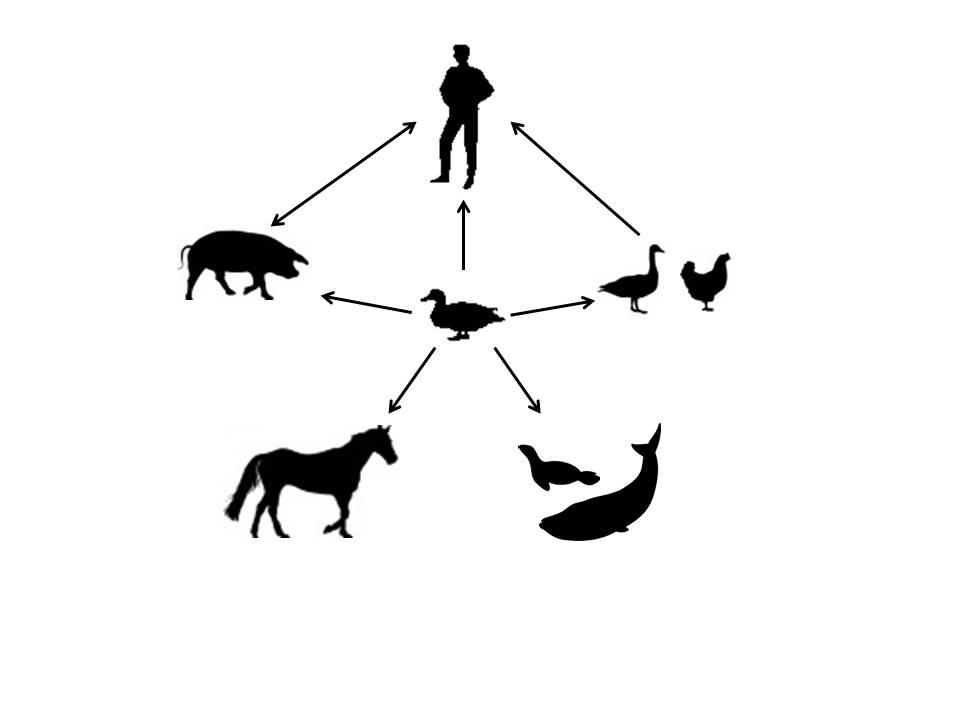
El reservorio natural “ancestral” de los virus de la gripe A son las aves acuáticas, en particular las de los órdenes Anseriformes (gansos, patos, etc) y Charadriiformes (gaviotas, charranes, fumareles, etc). Todos los virus de la gripe A que existen en la actualidad, y que incluyen virus aviares, humanos, porcinos, equinos, etc, han derivado en último término de los que comúnmente infectan a estas aves (Figura 3). Ello es consecuencia de un proceso de adaptaciones sucesivas, que a menudo involucra especies intermedias entre el hospedador ancestral y la adaptación final. Este proceso puede necesitar décadas hasta completarse.
¿Qué es lo que determina la adaptación de un virus de gripe A a una nueva especie de hospedador? Se conocen mutaciones en determinadas posiciones de las cadenas polipeptídicas de algunas de las proteínas de los virus de la gripe que están relacionadas con una mejor adaptación a determinadas especies de hospedadores. Por ejemplo, en la unión de los virus aviares al receptor celular propio de aves (α2,3 sialil glicano) juega un papel importante un número reducido de residuos aminoácidos que interaccionan directamente con el receptor (4). Determinados cambios o mutaciones en esas posiciones acarrean modificaciones en la afinidad de la HA para sus receptores, concretamente pueden aumentarla por el receptor predominante en las vías altas del tracto respiratorio de los mamíferos (α2,6 sialil glicano). La HA posee también un importante determinante de la patogenicidad de estos virus, consistente en el sitio de procesamiento proteolítico H0, que modula el tropismo tisular y la diseminación sistémica. Existen otras posiciones importantes en la cadena polipeptídica de la HA (4), pero además, el tropismo, la especificidad de hospedador y la patogenicidad no residen únicamente en la HA, sino que fuera de esta glicoproteína se han descrito varias posiciones clave en el genoma de los virus influenza tipo A que determinan no solo la patogenicidad sino también la adaptación a mamíferos, incluyendo la transmisibilidad entre éstos –lo cual se asume que se correlaciona con el potencial pandémico de determinadas cepas-, y a su identificación completa se han aplicado diferentes grupos de investigación, en estudios denominados “de ganancia de función” no exentos de polémica (6). Si bien la mutación puntual en sitios específicos tiene un papel relevante en la evolución de los virus gripales, como generadora de variantes genéticas con adaptaciones específicas, por sí sola no parece suficiente como para dar lugar a un virus pandémico. De hecho, se cree que la mayoría de los virus gripales pandémicos han surgido como consecuencia de fenómenos de reordenamiento genético (4).
De entre los pocos tipos de virus influenza tipo A capaces de superar la barrera entre las aves y el hombre, podemos distinguir, pues, dos tipos: 1) aquellos que han logrado adaptarse completamente a la especie humana, transmitiéndose en ésta de forma independiente de las aves, y 2) los que pueden transmitirse ocasionalmente desde las aves a los humanos, causando brotes esporádicos, pero no se transmiten eficazmente entre humanos. Mientras que los primeros quizá fueron en algún momento zoonóticos, pero ya no lo son, los segundos exhiben un comportamiento típicamente zoonótico. Los primeros son los causantes de las gripes pandémicas, que con el tiempo devienen en gripes estacionales. Como se señaló anteriormente, este proceso de adaptación puede durar décadas. Se ha podido determinar, por ejemplo, que el virus pandémico H1N1 de 2009 resultó de un triple reordenamiento que involucró a virus aviares, humanos, porcinos “clásicos” H1N1 y porcinos euroasiáticos. Los eventos clave que dieron origen a esta cepa pandémica tuvieron lugar probablemente entre 1990 y 2009 (7). En cuanto a los segundos, los zoonóticos sensu stricto, se han documentado brotes esporádicos de gripe aviar en humanos desde 1996, si bien destaca por su importancia sanitaria el subtipo H5N1 de origen asiático que desde su “debut” en 1997 en Hong Kong viene produciendo casos esporádicos de infección humanos de una elevada virulencia y se ha expandido por amplias zonas de Asia y África, alcanzando Europa en 2004-2006 y generando una gran alarma social (2). El último informe de la Organización Mundial de la Salud (OMS) disponible (8) cifra en 650 el número de casos humanos infectados por virus influenza H5N1 declarados a esta organización desde 2003, de los que han fallecido 386. Las cifras ponen de manifiesto una elevada mortalidad (60%), pero afortunadamente el virus no se transmite eficazmente entre humanos, lo que, unido a las medidas sanitarias y de control implementadas, ha hecho que el número de casos anuales se haya ido reduciendo paulatinamente desde los 115 en 2006 hasta 39 en 2013. Este virus sigue circulando activamente en amplias zonas del sureste asiático, así como en Egipto.
Al subtipo H5N1 mencionado hay que sumar otro que ha surgido más recientemente: se trata del subtipo H7N9 de influenza aviar zoonótica que debutó en el Este de China en marzo de 2013 y que, según la OMS en la última actualización disponible sobre este brote (9), ha causado más de 450 casos confirmados, prácticamente todos en China (excepto uno en Malasia, probablemente importado desde China), ocasionando también una elevada mortalidad (170 muertes, 38%). Al igual que el anterior no se transmite eficazmente entre humanos, pero a diferencia de aquél, que es muy virulento tanto para aves domésticas como silvestres, este no posee elevada patogenicidad para las aves, en las cuales la infección suele pasar desapercibida, lo que hace más difícil su seguimiento y control.
El carácter zoonótico de algunos virus de la gripe aviar es motivo de preocupación por el riesgo que supone para la aparición de cepas pandémicas con graves consecuencias para la salud pública. Desde 2004, la alerta sanitaria surgida alrededor de la expansión del subtipo H5N1 supuso un punto de inflexión que motivó un mayor nivel de concienciación y alerta ante el surgimiento de una posible nueva gripe pandémica. Ésta apareció de forma inesperada en Norteamérica en 2009, a partir de un subtipo H1N1 con componentes porcinos, humanos y aviares. La forma en que se efectuó el seguimiento de esta nueva gripe pandémica significó un hito en la historia de las enfermedades infecciosas, pues fue posible seguir su evolución prácticamente en tiempo real, algo inimaginable tan solo unos pocos años antes. A pesar de los enormes avances en este campo en los últimos años (4), aún no conocemos bien los detalles acerca de cómo surgen los virus gripales pandémicos. En cuanto a los actuales virus de gripe aviar causantes de zoonosis, aún se desconoce en gran medida cual es el riesgo de que desencadenen una nueva gripe pandémica, y la forma en que podrían hacerlo. Numerosos estudios en marcha se esfuerzan hoy por descifrar los interrogantes en torno a estas cuestiones de enorme relevancia y repercusión en salud pública.
Arbovirus aviares y zoonosis
Como ya se señaló en la introducción, existen dos grupos de arbovirus zoonóticos con reservorio aviar: uno pertenece a la familia Flaviviridae, género Flavivirus, y el otro a la familia Togaviridae, género Alphavirus. Entre los primeros se cuenta un numeroso conjunto de patógenos relevantes tanto en sanidad animal como en salud pública. Se trata principalmente de los flavivirus del serogrupo de la encefalitis japonesa, que comprende, además de al virus de la encefalitis japonesa (JEV) que da nombre al serogrupo, a los virus de la encefalitis de Saint Louis (SLEV), de la encefalitis del valle de Murray (MVEV), de la fiebre/encefalitis por virus West Nile (WNV) y al virus Usutu (USUV), a los que hay que añadir algunos otros flavivirus del serogrupo Ntaya, como los virus Rocío (ROCV) e Ilheus (ILHV), y algunos otros flavivirus menos conocidos y de menor importancia. El segundo grupo comprende ciertos alfavirus de importancia en salud pública, principalmente el virus Sindbis (SINV) y el virus de le encefalitis equina del Este (EEEV). Todos estos virus patógenos comparten ciertas características comunes, además de poseer como reservorio natural algunas especies concretas de aves silvestres y ser capaces de infectar y producir enfermedad en el ser humano:
- Son transmitidos por picaduras de artrópodos, generalmente mosquitos.
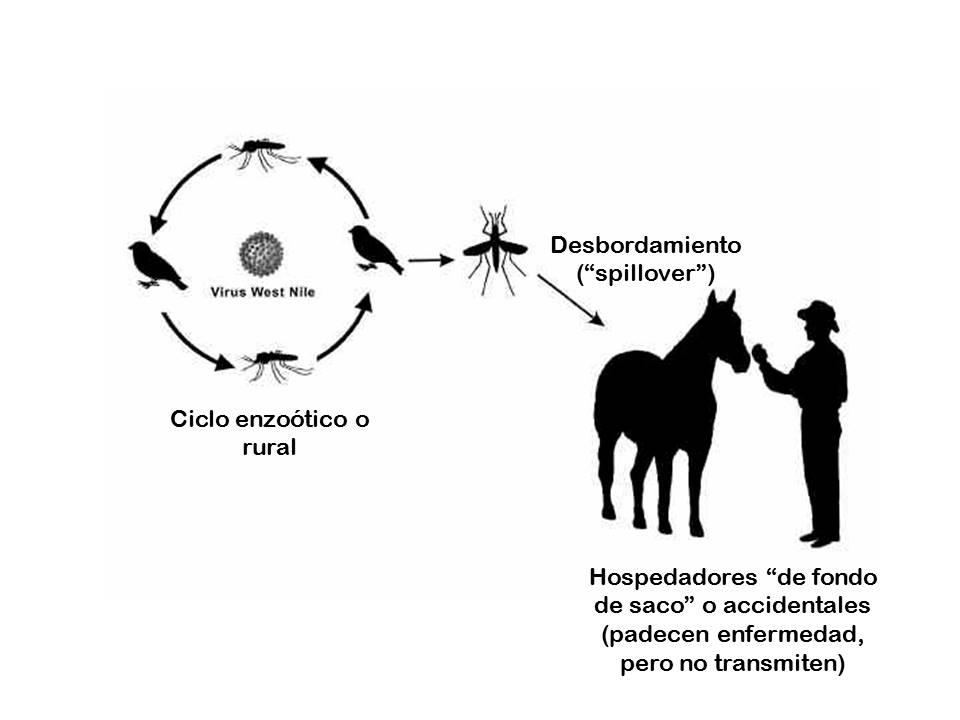
- Se mantienen en la naturaleza en un ciclo enzoótico o «rural» en el que el virus pasa de mosquito a ave y viceversa (Figura 4), siendo difícil detectar su actividad en esta fase.
- En determinadas ocasiones, el ciclo enzoótico se desborda, produciendo brotes epidémicos en el hombre y/o en los animales domésticos (a menudo, caballos) (Figura 4), causando patologías de severidad variable, desde signos leves y autolimitados como la fiebre hasta diversas manifestaciones neurológicas que pueden llegar a ser graves, sobre todo encefalitis y meningitis. Algunos de estos virus producen en humanos otro tipo de patologías, incluyendo afecciones cutáneas (exantema) y artralgias.
- El hombre y los animales domésticos susceptibles pueden padecer la infección y desarrollar enfermedad a consecuencia de ella, pero no transmiten el virus. Es lo que se conoce como “hospedadores de fondo de saco” o accidentales (Figura 4), y se debe a que el virus no alcanza en estas especies el nivel de viremia suficiente como para infectar un mosquito al picarles.
Algunos de estos virus han protagonizado en tiempos recientes episodios de emergencia y/o reemergencia, es decir, han modificado su rango geográfico, afectando a regiones donde, o bien nunca antes se habían descrito o hacía mucho tiempo que no se detectaban Esta expansión ha tenido lugar en general desde zonas tropicales y subtropicales hacia las zonas templadas del Planeta. Las razones de esta expansión son aún inciertas, pero no es aventurado señalar que el fenómeno del calentamiento global y los cambios climáticos asociados pueden ser factores determinantes en este proceso, dada la estrecha relación entre el clima y el ciclo vital de muchos vectores, y, probablemente, aunque en menor medida, de los hospedadores aviares (10).
El caso más señalado de expansión geográfica reciente de uno de estos arbovirus zoonóticos es el del virus West Nile, que constituye uno de los ejemplos más evidentes de enfermedad emergente/re-emergente que se puedan citar actualmente. Otro ejemplo también muy significativo, especialmente si hablamos del entorno Euro-Mediterráneo, es el del virus Usutu, poco conocido fuera de su hábitat original en el África Subsahariana, hasta su emergencia reciente en Europa. El resto del artículo irá dedicado a estos dos ejemplos de virus aviares zoonóticos en plena expansión en la actualidad. En cuanto al resto de los flavivirus y alfavirus zoonóticos mencionados anteriormente, algunos tienden a ampliar su rango geográfico, como el virus de la encefalitis japonesa, con incursiones en el norte de Australia, y otros tienen un rango geográfico bastante estable, pero todos ellos tienen potencial para protagonizar episodios de emergencia en nuevos territorios, tal y como lo han hecho ya WNV y USUV.
Virus West Nile (WNV): Entre los flavivirus aviares zoonóticos emergentes destaca el virus West Nile (o WNV por sus iniciales en inglés), cuyo nombre suele traducirse al español como «Nilo Occidental», «Oeste del Nilo» o simplemente » Nilo»[f]. Este virus afecta a un amplio rango de especies de vertebrados, entre ellas el hombre. El 80% de las personas que resultan infectadas por WNV no manifiestan ningún síntoma ni afección clínica. En la mayor parte del 20% restante se produce una enfermedad leve conocida como «fiebre por WNV» que en la mayoría de los casos se limita a signos inespecíficos como fiebre, mialgia y fatiga, a veces acompañados de exantema, vómitos, diarreas y linfadenopatía, que se resuelven sin complicaciones. Sin embargo, en unos pocos casos (se estima que uno de cada 150 casos clínicos) se desarrolla una enfermedad más grave («enfermedad neuroinvasiva por WNV»), que afecta al sistema nervioso central, y que se manifiesta en forma de encefalitis, meningitis o parálisis. Entre el 4 y el 14% de los casos de enfermedad neuroinvasiva son mortales (revisión en (12)). El virus afecta también a otros vertebrados, principalmente a caballos, en los que produce una enfermedad neurológica grave en un 10% de los casos clínicos, letal en 1/3 de los casos graves (revisión en (13)). Ni los equinos ni los humanos transmiten la enfermedad, al menos de forma natural (Figura 4).
El WNV se mantiene en la naturaleza en un ciclo enzoótico entre mosquitos, que constituyen los vectores, y aves, que constituyen los reservorios epidemiológicos. El WNV es considerado un generalista ecológico por la gran diversidad de hospedadores vertebrados que puede infectar, incluyendo no solo aves y mamíferos, sino también reptiles y anfibios. Sin embargo, solamente determinadas especies de aves pueden actuar como hospedadores competentes para la transmisión, constituyendo los auténticos reservorios epidemiológicos. Entre éstas, destacan algunas especies de Passeriformes, pero también aves silvestres pertenecientes a otras familias, existiendo diferencias notables a este respecto entre especies de aves pertenecientes a la misma familia (14). De igual modo, aunque el WNV es capaz de infectar a una gran variedad de artrópodos, incluyendo un amplio rango de mosquitos y garrapatas; sin embargo, solo determinadas especies de mosquitos actúan eficazmente como vectores competentes para la transmisión, entre ellas destacan diversas especies ornitofílicas del género Culex, ampliamente distribuidas por todo el mundo (15).
El que el virus West Nile circule en un territorio viene determinado básicamente por la presencia en el mismo de vectores y hospedadores competentes en suficiente número. En tal «sustrato», compatible con la circulación del virus, éste prosperará si es introducido en la zona. La introducción puede ser natural (movimientos naturales -migratorios o no- de aves infectadas, o de mosquitos, que empujados por el viento pueden salvar distancias respetables) o mediada por las actividades humanas (por ejemplo, el comercio de animales exóticos, entre otras). En Europa circulan diferentes linajes genéticos del virus, pero los dos más importantes desde el punto de vista sanitario, los linajes 1 y 2, son compartidos con el pool de virus del África Subsahariana, y se cree que han llegado a Europa en diferentes eventos de introducción, probablemente a través de la migración de las aves. No obstante, estos eventos de introducción son raros e infrecuentes, como demuestran las relaciones filogenéticas existentes entre los distintas cepas de WNV aisladas en Europa, que revelan un número muy limitado de tipos genéticos: dos de linaje 1 (Euromediterráneo occidental e Israelo-Europeo oriental) circulando desde los años ’90 del siglo XX, y dos de linaje 2 (Centro-Sur Europeo y Ruso-Rumano), circulando y expandiéndose desde 2004, sugiriendo una dinámica de introducción ocasional, seguida de circulación local, endemización y dispersión a regiones vecinas (16).
El virus West Nile era considerado un virus tropical africano de poca importancia hasta hace poco. Fue descrito por primera vez en Uganda (distrito de West Nile, de ahí su nombre) en 1937. En los años ’50 del siglo XX se encontró en Egipto y en Oriente Medio, donde se describieron los primeros casos de enfermedad neuroinvasiva en humanos. Tuvo apariciones esporádicas a lo largo de la cuenca del Mediterráneo en los años ’60 y ’70, causando algunos brotes de enfermedad en caballos. Tras una ausencia de dos décadas, a finales de los ’90 del siglo XX volvió a aparecer en el Mediterráneo y en Europa del Este, y desde entonces no ha parado de aumentar su incidencia y rango geográfico (13).
Pero si en Europa el virus West Nile se ha expandido de forma notable en los últimos 15 años, lo que ha ocurrido aproximadamente al mismo tiempo al otro lado del Atlántico ha sido una expansión sin precedentes: desde su introducción en Nueva York en 1999, y en tan solo 4 años, el virus invadió Norteamérica de costa a costa y de México a Canadá, causando una epidemia de enormes proporciones, que afectó severamente a miles de personas y causó estragos igualmente en equinos y aves. A diferencia de Europa, en América las aves si resultaron muy afectadas, quizá porque las especies de aves americanas sean más susceptibles a enfermar por este virus de lo que lo son sus homólogas europeas. Tan sólo en Estados Unidos, el virus ha causado hasta hoy alrededor de 40.000 casos clínicos diagnosticados en humanos, de los que más de 1.600 han sido mortales (17). El virus, que ya es considerado endémico en Norteamérica, ha proseguido su expansión hacia América del Sur, donde llegó a alcanzar territorio argentino en 2006. Está presente igualmente en Centroamérica y el Caribe, donde ha llegado igualmente desde el Norte, si bien la incidencia de la enfermedad disminuye cuanto más se desciende en latitud, un fenómeno aún no explicado satisfactoriamente.
El virus West Nile no solo se ha dispersado muy eficazmente por Europa y América, sino que ha alcanzado una distribución mundial, estando presente hoy día en todos los continentes habitados de la Tierra. Las claves del éxito reciente de este virus podrían residir en su ya mencionado carácter «generalista», capaz de infectar a un gran número de especies de vertebrados y prosperar eficazmente en muchas de ellas, así como ser transmitido por una importante variedad de mosquitos, de amplia distribución en el mundo. Aunque el papel del cambio climático en esta expansión es aún incierto, y sin duda han influido otros factores, se especula que el calentamiento global ha podido «empujar» a este virus hacia zonas más templadas del Planeta.
Virus Usutu: En 2001, durante un episodio de mortalidad masiva de mirlos (Turdus merula) en los parques de Viena (Austria) se identificó un flavivirus hasta el momento desconocido en Europa, denominado virus Usutu. Se trata de un virus muy similar al virus West Nile desde el punto de vista genético y antigénico. Las similitudes también incluyen su origen africano (el virus Usutu fue descrito por primera vez en Sudáfrica en 1959, y ha sido detectado en humanos y en mosquitos en diversos países del África Subsahariana antes de su aparición en Europa), y su ciclo de transmisión, con reservorios aviares y mosquitos como vectores. El virus Usutu es un patógeno importante para determinadas especies de aves susceptibles, entre ellas los mirlos. El ser humano puede resultar infectado, si bien este es un fenómeno más raro que en el caso del virus West Nile. La infección es a menudo asintomática, aunque en ocasiones puede causar signos leves (fiebre, exantema). En algunos casos se ha producido una infección más severa, en pacientes con diversas patologías de base (18), aunque muy recientemente se han descrito infecciones virulentas en personas sin patologías previas conocidas, en un brote de enfermedad neuroinvasiva ocurrido en Croacia en 2013, que coincidió con un brote por WNV (19). Desde el año 2001 en que alcanzó Centroeuropa[g], el virus no ha cesado de expandir su rango geográfico en este continente, habiendo sido detectada su presencia en Austria, Hungría, Suíza, Italia, España y más recientemente, en Alemania. Es notable el hecho de que a menudo co-circula con WNV, lo cual supone dificultades en cuanto al diagnóstico diferencial, pues existe reactividad cruzada entre ambos virus en las pruebas serológicas disponibles (21). El virus Usutu no ha sido detectado por el momento fuera de África, Europa y la zona mediterránea.
NOTAS
[a] En este artículo usaremos indistintamente las denominaciones influenza y gripe, equivalentes en español (3)
[b]Existen virus patógenos aviares relevantes en las familias Circoviridae; Coronaviridae; Flaviviridae; Herpesviridae; Orthomyxoviridae; Paramyxoviridae; Parvoviridae; Picornaviridae; Polyomaviridae, Poxviridae; Reoviridae; Retroviridae; y Togaviridae, principalmente.
[c] Recientemente se han identificado variantes de virus de la influenza aviar en pingüinos antárticos, ampliando aún más el rango geográfico conocido de estos virus.
[d] Dieciocho HA y once NA, si incluimos los dos nuevos subtipos de influenza A encontrados muy recientemente, uno en pingüinos antárticos (mencionado en la nota al pie anterior) y el otro en murciélagos. Éste último no se ha encontrado en aves, por el momento.
[e] A éstos hay que añadir H10, puesto que recientemente (2013) fue notificado el primer caso –y hasta ahora único- de una persona que adquirió una infección por H10N8, probablemente por contacto con aves de corral, y que murió a consecuencia de la neumonía severa provocada por la infección.
[f] Ninguna de estas traducciones es correcta, como ya se discutió en otro lugar (véase referencia (11)).
[g] Retrospectivamente se ha sabido que el virus Usutu ya circuló -y fue responsable de brotes de mortalidad en aves silvestres- en el Norte de Italia en 1996 (20).
Referencias
- Jiménez-Clavero, MA. 2010. Influenza, gripe, «gripe española», «gripe porcina» y otras controversias en la denominación de los virus: El lado «políticamente incorrecto» de la virología. Enfermedades Infecciosas y Microbiología Clínica 11/2010; 28(9):662–663.
- González González, G. 2006. La influenza aviar. Insistencia mediática, alarma social y efectos socio-económicos. En: Monografías de la Real Academia Nacional de Farmacia, Monografía XXI: Influenza aviar y gripe humana de origen aviario. Cap 2. Editor: Bernabé Sanz Pérez. Enlace: http://www.analesranf.com/index.php/mono/article/viewFile/594/611.
- Chen S, Cheng A, Wang M. Innate sensing of viruses by pattern recognition receptors in birds.Vet Res. 2013 Sep 9;44:82. doi: 10.1186/1297-9716-44-82. Review.
- Medina R, García-Sastre A. 2011. Influenza A viruses: new research developments. Nature Reviewes Microbiology 9:590-603 doi:10.1038/nrmicro2613.
- Chen, R. y Holmes, EC. 2006. Avian influenza virus exhibits rapid evolutionary dynamics. Mol Biol Evol. 2006 Dec;23(12):2336-41. DOI: 10.1093/molbev/msl102.
- Casadevall A, Imperiale MJ. Risks and benefits of gain-of-function experiments with pathogens of pandemic potential, such as influenza virus: a call for a science-based discussion. MBio. 2014 Aug 1;5(4):e01730-14. doi: 10.1128/mBio.01730-14.
- Trifonov, V., Khiabanian H, Rabadan R. 2009. Geographic Dependence, Surveillance, and Origins of the 2009 Influenza A (H1N1) Virus. N Engl J Med 361:115-119 doi: 10.1056/NEJMp0904572.
- WHO. 2014. Cumulative number of confirmed human cases for avian influenza A(H5N1) reported to WHO, 2003-2014. Enlace: http://www.who.int/influenza/human_animal_interface/EN_GIP_20140124CumulativeNumberH5N1cases.pdf (Acceso: 22 de agosto de 2014).
- WHO. 2014. Confirmed human cases of avian influenza A(H7N9) reported to WHO. Enlace: http://www.who.int/influenza/human_animal_interface/influenza_h7n9/18_reportwebh7n9number_20140714.pdf?ua=1 (Acceso: 22 de agosto de 2014).
- Jiménez-Clavero, MA. 2012. Animal viral diseases and global change: bluetongue and West Nile fever as paradigms. Frontiers in Genetics 06/2012; 3. DOI: 10.3389/fgene.2012.00105-3.
- Jiménez-Clavero, MA. 2009. West Nile o Nilo Occidental. Enfermedades Infecciosas y Microbiología Clínica 05/2009; 27(5):308.
- Pérez Ruiz, M., Sanbonmatsu Gámez, S., Jiménez Clavero, MA.: Infección por virus West Nile. Enfermedades Infecciosas y Microbiología Clínica 01/2011; 29(Supl 5-29 (Supl 5)):21-26.
- Sotelo, E., Fernández-Pinero, J., Jiménez-Clavero, MA.: La fiebre/encefalitis por virus West Nile: reemergencia en Europa y situación en España. Enfermedades Infecciosas y Microbiología Clínica 11/2011; 30(2):75-83.
- Pérez-Ramírez E, Llorente F, Jiménez-Clavero MA. Experimental Infections of Wild Birds with West Nile Virus. Viruses 2014, 6(2), 752-781; DOI:10.3390/v6020752.
- Engler O., Savini G.,, Papa A.,, Figuerola J., Groschup, MH., Kampen H., Medlock J., Vaux A., Wilson AJ., Werner D., Jöst H., Goffredo M., Capelli G., Federici V., Tonolla M., Patocchi N., Flacio E., Portmann J., Rossi-Pedruzzi A., Mourelatos S., Ruiz S., Vázquez A., Calzolari M., Bonilauri P., Dottori M., Schaffner F., Mathis A., Johnson N. 2013. European Surveillance for West Nile Virus in Mosquito Populations. Int. J. Environ. Res. Public Health 2013, 10, 4869-4895; DOI:10.3390/ijerph10104869
- Sotelo E, Fernández-Pinero J, Llorente F, Vázquez A, Moreno A, Agüero M, Cordioli P, Tenorio A, Jiménez-Clavero MÁ. 2010. Phylogenetic relationships of Western Mediterranean West Nile virus strains (1996-2010) using full-length genome sequences: single or multiple introductions? J Gen Virol. 2011 Nov;92(Pt 11):2512-22. DOI: 10.1099/vir.0.033829-0.
- CDC 2014. West Nile virus disease cases and deaths reported to CDC by year and clinical presentation, 1999-2013. Enlace: http://www.cdc.gov/westnile/resources/pdfs/cummulative/99_2013_CasesAndDeathsClinicalPresentationHumanCases.pdf (Acceso: 26 de agosto de 2014).
- Vazquez A., Jimenez-Clavero MA., Franco L., Donoso-Mantke O.,, Sambri V.,Niedrig M., Zeller , Tenorio A. 2011. Usutu virus: potential risk of human disease in Europe. Eurosurveillance 01/2011; 16(31).
- Vilibic-Cavlek T1, Kaic B, Barbic L, Pem-Novosel I, Slavic-Vrzic V, Lesnikar V, Kurecic-Filipovic S, Babic-Erceg A, Listes E, Stevanovic V, Gjenero-Margan I, Savini G. 2014.First evidence of simultaneous occurrence of West Nile virus and Usutu virus neuroinvasive disease in humans in Croatia during the 2013 outbreak. Infection. 42(4):689-95. DOI: 10.1007/s15010-014-0625-1.
- Weissenböck H, Bakonyi T, Rossi G, Mani P, Nowotny N. 2013. Usutu virus, Italy, 1996. Emerg Infect Dis. 19(2):274-7. DOI: 10.3201/eid1902.121191.
- Beck C, Jimenez-Clavero MA, Leblond A, Durand B, Nowotny N, Leparc-Goffart I, Zientara S, Jourdain E, Lecollinet S. 2013. Flaviviruses in Europe: complex circulation patterns and their consequences for the diagnosis and control of West Nile disease. Int J Environ Res Public Health. 2013 10(11):6049-83. DOI: 10.3390/ijerph10116049.
