![]()
Congreso Internacional sobre Herpesvirus 2016. Madison (USA)
Ya avisé y me tengo por un hombre de palabra. A pesar de que algún que otro problemilla de salud me ha obligado a ausentarme –contra mi voluntad- de la primera línea de la comunicación social de la ciencia, aquí va el informe-resumen prometido. Una versión forzosamente más sintética y resumida aparecerá, asimismo, en la Revista de la Sociedad Española de Virología y, en la medida de mis posibilidades, en RNE y TV.
Un año más, y ya van 41 ediciones, se ha celebrado la reunión anual internacional más importante sobre herpesvirus y, como casi todos los años, una ciudad estadounidense –en esta ocasión Madison, capital de Wisconsin- ha visto aumentada su pequeña población con algo más de medio millar de grandes expertos en todos los grupos de la prolífica familia Herpesviridae. La representación española, a excepción de algunos investigadores afincados en laboratorios casi todos ellos norteamericanos, ha sido completamente testimonial. Solo la presentación del trabajo de mi pequeño grupo sobre un antiviral antiherpético, y mi acento anglo-extremeño, rompían la completa hegemonía anglosajona, germana y asiática. Aquí traigo un resumen, forzosamente subjetivo, sobre aquellas conferencias y presentaciones de las que fui testigo.
Además de una jornada satélite sobre las tres subfamilias de los herpesvirus, con protagonismo para los herpes simplex (HSV), varicela (VZV), Epstein-Barr (EBV) o citomegalovirus (HCMV), cuatro sesiones muy intensas dieron cuenta de casi todos los aspectos moleculares, celulares y clínicos que subyacen tras las infecciones de estos agentes infecciosos que suelen tener la habilidad, tras una infección aguda, de entrar en latencia en diferentes tejidos y órganos, pudiendo estar implicados en la etiología o desarrollo de diversas patologías. En la presente edición mundial se ha prestado especial interés a nuevos posibles compuestos antivirales, desarrollo de vacunas o utilización de estos virus complejos en la elaboración de otras terapias. No obstante, aspectos menos clínicos, más moleculares como la entrada, tráfico viral dentro y fuera de la célula, replicación y, claro está maduración, salida y expansión viral tuvieron merecida presencia en las múltiples conferencias plenarias, presentaciones orales en sesiones paralelas o debates científicos “face to face” frente a los pósteres-resumen de trabajos puntuales.

Avisando de que en la presente visión-resumen forzosamente personal no estarán todas las presentaciones sobre herpesvirus que fueron, sí procuraré que, al menos, sean todas las que, a continuación, presentaré. Trataré aspectos concretos sobre entrada viral, tráfico intracelular, replicación, salida, expansión, implicación en diferentes patologías, defensa inmunológica, desarrollo terapéutico, vacunas y, ya puestos, utilización de los herpesvirus como herramientas anticancerígenas.
Sobre la posibilidad de que los virus herpes utilicen varias vías de entrada en las células que infectan, se habló largamente. Científicos de la Universidad Estatal de California han conseguido aumentar la entrada viral en células sin receptores utilizando complejos como el de la lipofectamina. Con este complejo de liposomas catiónicos, las moléculas de heparán sulfato aumentan su efectividad arrastrando al virus al interior de la célula en un proceso dependiente de endocitosis. Algo que ya se conocía era que, en ciertas condiciones, herpes necesita una bajada de pH moderada para su entrada en la célula, pero si ese tratamiento con bajo pH se llevaba a cabo en los viriones antes de la infección, dicha entrada no tenía lugar, indicando que el cambio de conformación necesario para la penetración del virus en la célula por fusión de las membranas tiene que producirse en el momento preciso, no antes. Según parece, la bajada moderada de pH provocaría un cambio conformacional en un dominio concreto de gB, no a su estructura global, haciendo a esta glicoproteína más hidrofóbica, algo necesario para la fusión celular. En otro orden de cosas y pasando del HSV al HCMV, investigaciones llevadas a cabo en la Universidad de Montana permite distinguir las dos principales vías de entrada viral, esto es, fusión de membranas mediada por gB o no fusión, a través de los complejos formados en cada caso: las proteínas virales gH/gL/gO en el primer caso, y gH/gL/UL128-131 a través de un mecanismo independiente, arrojando nueva luz sobre la entrada de partículas virales libres y la expansión de virus célula-célula. Por otra parte, si nos fijamos en el EBV, según se mostró desde la Universidad de Lousiana, solo los complejos gH-gL-gp42 permiten una correcta entrada del virus en los linfocitos B. Finalmente en cuanto a la entrada viral, en investigaciones llevadas a cabo en la Universidad de Kobe, Japón, se estudiaron los dos receptores distintos que utilizan los herpesvirus humanos 6A y B (HHV-6) para entrar en la célula. En el caso de HHV-6B, el receptor celular sería la molécula CD134, donde las glicoproteína virales gQ1 y gQ2 serían, al contrario que con HHV-6A, cruciales.
Dejamos, por ahora, el proceso de entrada viral y saltamos al opuesto, la salida. Estudios con el virus de la pseudorrabia llevados a cabo en la Universidad de Princeton apuntan a procesos independientes del potencial de acción de las neuronas, gobernados por la proteína celular Rab3 y Rab27, como necesarios para la salida y expansión viral. Y ya que hablamos de neuronas, desde la Escuela Superior de Medicina de Hannover, en Alemania, señalan a dos proteínas conocidas de HSV, las pUL36 y 37, como implicadas en la entrada y transporte de los viriones a través del axón para el transporte a neuronas vecinas, abriéndose nuevos frentes de investigación. Finalmente, en esta sección, un estudio curioso nos llegó desde la Universidad de Cambridge, en Reino Unido, donde observaron que si mutábamos ciertas proteínas de HSV-1, concretamente gI, junto a UL43 y UL44, el virus cambiaba su tendencia de salida celular de forma ordenada, por puntos de contacto célula-célula, por otra más difusa, anárquica, a través de casi toda la membrana celular.
En cuanto al bloque sobre replicación y otros procesos del ciclo viral, por supuesto, en un formato casi telegráfico, querría destacar algunas pinceladas. Desde Hamburgo, y la Escuela Médica de Hannover, nos presentaron algo realmente novedoso. En contra de lo que se pensaba, esto es, que el transporte nuclear de HSV-1 dependía de la organización activa de filamentos como la actina, la arquitectura nuclear, mediante movimientos por difusión pasiva a través de pasillos (corrales) sería crucial para el movimiento viral. No hablamos, por lo tanto, de transporte activo como se pensaba hasta la fecha. Según el modelo –y estudios de microscopía con inhibidores como la Latrunculina A– no haría falta la polimerización de los filamentos de actina para el transporte y salida nuclear de los viriones de HSV-1. Y ya que hablamos de salida nuclear de herpes, Jun Arii, Universidad de Tokio, presentó al ESCRT-III (Endosomal sorting complex required for transport-III), implicado en procesos de formación de microvesículas extracelulares, como un complejo importante en la salida de HSV-1 del núcleo, eso sí, junto a la proteína viral Us3. No abandonamos Alemania. Desde el Centro Helmholtz de Munich, se nos presentaron los primeros momentos de la infección de linfocitos B por el EBV. Al parecer, estas células inmunocompetentes aumentarían de tamaño, se activarían evolucionando hacia un estadio linfoblastoide, inmortalizándose o transformándose, en algunos casos. No se sabe cómo los genes virales organizan todos estos cambios celulares, modulando la expresión, por ejemplo, de TAP-2 y la producción de ciertas interleuquinas como la IL-12. Finalmente, para terminar con este apartado, desde la Escuela Médica de Harvard, en Boston, se volvió a insistir en el importante papel que ICP0 –estudiado en HSV-1- jugaría en el mantenimiento de la latencia y entrada en ciclo lítico a través de posibles asociaciones con el nucleosoma.
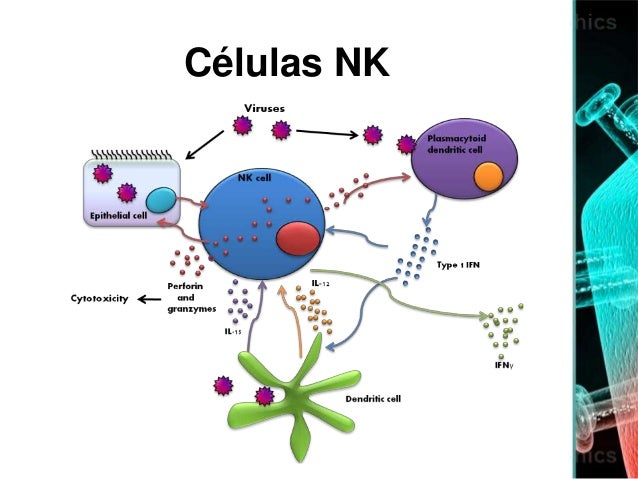
En cuanto a la asociación de las infecciones por herpesvirus con la inducción de enfermedades, algunos “botones” serían los siguientes. Mediante el análisis de hasta 7 cepas distintas de HCMV se comprobó el papel de la Caspasa2 en la muerte celular, por apoptosis, tras la infección. Según el Instituto Heinrich Pette de Hamburgo, solo dos cepas virales promovían dicha muerte celular programada en fibroblastos. Asimismo, algo que sigue dividido en facciones –los que estudian EBV, HHV-6 o, como mi laboratorio, HSV-1-, la implicación de algunos herpesvirus en Esclerosis Múltiple (EM) sigue con su controversia. Un trabajo de la Universidad Médica Erasmus, en Rotterdam, comprueba el papel de los linfocitos T CD4 secretores de IFN gamma y de IL-17 –algo ya conocido- y de los linfocitos CD8, algo que hasta la fecha se desconocía, en EM. Estos linfocitos actuarían, según los autores, frente a antígenos de EBV. Este ataque a epítopos virales provocaría un proceso inflamatorio, con activación de la microglía del sistema nervioso central, que dañaría al tejido nervioso. Todo ello se llevó a cabo analizando el líquido cefalorraquídeo de 29 pacientes con EM. Y ya que hablamos de la implicación o el paralelismo entre infecciones con herpesvirus y procesos patológicos, Jim Alwine, Penn Medicine, Pensilvania, EE.UU. mostró la relación entre HCMV y algunos tipos de cáncer, al menos, en cuanto a la inducción de la lipogénesis. Estudiando un sistema, quizás, se pueda profundizar en los aspectos moleculares de algunos tipos de tumores. Por supuesto, no querría olvidarme de la varicela (VZV), un virus polémico por los aspectos sociales sobre su profilaxis –vacuna sí, vacuna no-. Al parecer, y según nos presentaron desde la Universidad de Sidney, Australia, el potencial anti-VZV de las células NK, aun siendo crucial, ha sido poco estudiado. Individuos infectados, deficientes para funciones NK tendrían una mayor diseminación viral con mayor virulencia. La infección de células epiteliales provoca la modulación del ligando para NKG2D, un potente receptor activador expresado en células NK. Finalmente, este bloque sobre virus y enfermedad querría cerrarlo con, según estudios de la Universidad de Connecticut, la respuesta celular al estrés e infección por HSV. Tanto la respuesta innata como la adaptativa, así como diversos factores de restricción expresados de forma constitutiva, constituirían la verdadera primera línea de defensa contra la infección. HSV-1 puede manipular la respuesta de estrés celular a través de sus dos vertientes: afectando a los mecanismos de protección contra el daño al DNA y mediante la interferencia con las denominadas Proteínas de Control de Calidad (Protein Quality Control ó PQC). ICP0 e ICP22 de HSV serían actores muy activos en este control de la respuesta celular contra el estrés y, por extensión, de parte de los mecanismos antivirales celulares.
Uno de los bloques, quizás, más completos y prometedores hizo referencia a las terapias -profilácticas, vacunas o tratamientos varios- en torno a, y hacia, la familia Herpesviridae. Por supuesto, el trabajo de mi propio grupo sobre la actividad antiherpética del ácido valproico (VPA) en oligodendrocitos no pudo faltar, al menos, en la sesión de pósteres. En una línea similar, desde la Universidad de Wisconsin-La Crosse y la Escuela Universitaria de Medicina de Yale se mostró cómo un derivado del VPA, Valpromida (VPM) era efectivo contra infecciones por EBV inhibiendo tanto su replicación como la reactivación viral en linfomas de Burkitt, bloqueando varias fases de la expresión génica vírica. En cuanto a otras drogas antiherpéticas de índole inespecífico, Lynda Morrison, Escuela Universitaria de Medicina de San Luis, EE.UU., observó cómo los antifúngicos Ciclopirox y Piroctone eran efectivos contra HSV-1, ya que protegen de varios pasos de modificación genética del DNA requerido durante el ciclo viral con la participación de componentes celulares comunes, tales como las enzimas NTS (superfamilia de las nucleótido transferasas). Lo más alentador es que estas drogas antifúngicas resultaron ser, incluso, efectiva contra mutantes víricos resistentes al aciclovir. Por su parte, y aprovechando la necesidad de algunos virus de la modificación del pH para penetrar en el interior de la célula, Keiko Ikeda, Universidad de Okayama, Japón, sugiere que la Arginina –en una solución de HCl pH 4- eliminaba la infectividad de HSV-1, un trabajo, dicho sea de paso, que personalmente considero más que preliminar. También se presentaron, desde el Instituto de Virología del Hospital Universitario de Essen, Alemania, unos anticuerpos monoclonales, humanizados, capaces de tratar y proteger a ratones inmunodeficientes contra HSV. Los anticuerpos eran específicos contra la gB viral (hu2c). La idea que subyace es un futuro tratamiento contra la posible infección ocular por herpes –la ceguera herpética es, de hecho, la principal causa de pérdida de visión por virus en nuestra especie. Por supuesto comentar, al menos, el par de consideraciones que Betsy Herold, del Albert Einstein College de Medicina, EE.UU. hizo sobre el desarrollo de futuras vacunas contra HSV. En concreto, la presentación se centró en una vacuna HSV-2 recombinante mediante un mutante de deleción gD. De momento, al parecer, se trata de una vacuna segura, que no recombina, produce altos títulos virales y hace aumentar los niveles de los Th CD4 y CD8. La prueba en ratones consigue protegerlos contra la infección, al menos como vacuna “pasiva”, activando, a su vez, el mecanismo ADCC (citotoxicidad celular dependiente de anticuerpo). Ya puestos, también protegería frente a la latencia.
No querría terminar este informe-resumen sin, tan siquiera, mencionar la interesante conferencia ofrecida por Howard Kaufman, Rutgers University, EE.UU. sobre la utilización de herpes recombinante como agente oncolítico contra ciertos melanomas. Para ello, se ha elaborado un HSV-1 oncolítico que codificaba para GM-CSF y que activa, como tratamiento inmunoterapéutico, la respuesta innata y la CD8+. El producto se llama Talimogene laherparepvec (o simplemente T-VEC), efectivo contra melanomas. T-VEC causa necrosis y replica solo en células cancerígenas, pudiéndose administrar de forma ambulatoria. Ya ha curado a pacientes reales y ha sido aprobado por la FDA para tratar ciertos melanomas, eso sí, algunos posibles efectos secundarios tienen que ser, todavía, considerados. Los expertos proponen su futuro uso combinado con otros compuestos inhibidores denominados T-cells checkpoints.
Hasta aquí mi personal –e intransferible- visión de lo que fueron unos días de intensos debates y presentaciones científicas en la calurosa y húmeda ciudad de Madison, con su Capitol, copia –o inspiración- del de Washington. Ahora, un año más, a esperar a la próxima edición. Según nos informaron, Gante, en Bélgica, ha sido la elegida. Bonne chance!
DIVULGACIÓN CIENTÍFICA DEL 23 DE JULIO DE 2016
Esta semana mi+dtv trata de cómo los genes condicionan nuestra conducta; lasenfermedades metabólicas hereditarias; la expansión demográfica de los pulpos.
Por si se le ocurre hacerlo así, a las bravas, sin método y fórmula, decirle que el famoso cubo de Rubik, el más sencillo, el de toda la vida, cuenta con el siguiente número de posiciones distintas:
433 252 0032 274 4891 856 000 opciones distintas. Hoy, en Entre Probetas hablaremos de las matemáticas que se esconden detrás de este juguete, de la locura de su inventor y, ya puestos, le daremos fórmulas para completarlo con éxito. Hablamos con la plataforma IberoRubik. También, en final de temporada, hablaremos de arroz dorado y de otras noticias de actualidad.
…
MADRI+D TV (Divulgación científica con cara, e imágenes, en 3 minutos)
ENTRE PROBETAS (25 minutos de intensa y entretenida ciencia). Radio 5
EL LABORATORIO DE JAL (Píldoras científicas en 3 minutos). Radio 5
MARCA ESPAÑA (A CIENCIA CIERTA) Radio Exterior de España
FACEBOOK (José Antonio López-Guerrero)
FACEBOOK (Departamento de Cultura Científica -Centro de Biología Molecular)
TWITTER (JALGUERRERO)
TWITTER (DCCientificaCBM)
LINKED-IN (Jal Guerrero)