![]()
Red ferroviaria bacteriana: el transporte en espiral a lo largo de una célula
autor: Miguel Vicente
La versión en inglés de este artículo se ha publicado en Small things considered «The Microbe Blog»
Un sevillano contaba/ a un patán que oyendo estaba/ las grandezas que encerraba/ la Iglesia del Vaticano:/ Mira tú si habrá extensión/ que el que oyendo misa esté/ en la iglesia, al cura ve/ del tamaño de un piñón./ -¿Y hay altares?/ -Más de mil; el mayor es colosal,/ baste decir que el misal/ lo mudan en ferrocarril.
Si las bacterias no hubieran optimizado los procesos que utilizan para crecer y multiplicarse muy posiblemente no hubieran logrado pervivir y colonizar la mayoría de los ambientes del planeta Tierra. Los textos de Biología con los que estudiábamos en el siglo 20 despachaban la descripción de cómo se dividen las bacterias con un sola frase “por fisión binaria simple”. Nada más lejos de la realidad que la cosa sea “simple”, hoy en día sabemos que, en Escherichia coli, solo para que se forme el tabique que separará a las dos hijas resultantes de la división se necesitan más de una docena de proteínas que se ensamblan siguiendo una secuencia compleja y en la que basta con que falle una de las etapas para que se produzca una catástrofe que impide el ensamblaje de las demás, y por consiguiente que fracase la división. Y es más, antes de que se inicie el ensamblaje de esta maquinaria es preciso que la primera proteína que lo inicia, llamada FtsZ, encuentre la forma de colocarse en el centro exacto de la célula. Esto asegura que el citoplasma y el ADN de la madre, convenientemente duplicados, se repartan por un igual entre las dos hijas.
En busca del centro
Hay al menos dos procedimientos que aseguran la colocación de FtsZ en el centro de la célula, uno de ellos es que FtsZ no funciona en las zonas ocupadas por el cromosoma, que en las bacterias forma una estructura llamada nucleoide. Es un fenómeno al que Conrad Woldringh, un profesor de Amsterdam, bautizó como “oclusión por el nucleoide”. El otro, independiente del nucleoide, funciona estableciendo un gradiente en la concentración de otro inhibidor de FtsZ llamado MinC. El estudio de este mecanismo fue impulsado por Lawrence Rothfield, un profesor de Connecticut.
Repulsión o atracción
A su vez, se han descubierto dos procedimientos por los que se establece el gradiente del inhibidor MinC en distintas bacterias, de forma que su concentración es en cualquier caso mayor en los extremos de la bacteria. MinC está asociada a otra proteína MinD, que se coloca en la membrana citoplásmica. Bacterias como Escherichia coli obligan a la pareja MinCD a abandonar el centro y oscilar de una punta de la célula a la otra mediante otra proteína más, MinE. Por el contrario en otras bacterias, de las que Bacillus subtilis es la mejor estudiada, MinCD son atraídas por otra proteína llamada DivIVA que se pega a los dos extremos pero no al centro.
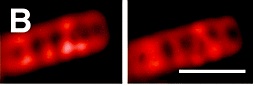
Dos imágenes de la misma célula de B. subtilis en la que se han teñido las espirales de ípidos de la membrana. Cada imagen se ha tomado a una profundidad diferente. Foto: Mol. Microbiol. 68: 1315–1327.
Red ferroviaria
En cualquier caso ¿cómo se las arreglan estas proteínas para viajar a lo largo de la célula? Ahora investigadores de la Academia de Ciencias de Eslovaquia y de la Universidad de York han encontrado que en la membrana de B. subtilis existen algunos lípidos que forman raíles con forma de espiral a los que se asocia MinD, arrastrando con ella MinC. Para detectarlos han utilizado tintes fluorescentes que se unen con preferencia a un tipo de fosfolípidos, a los que también se une preferentemente MinD.
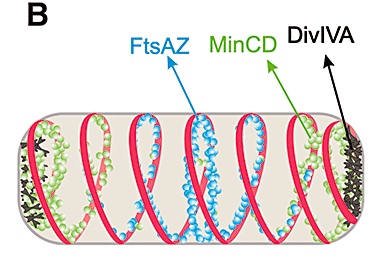
Las proteínas de división: mercancías distribuídas por la red ferroviaria de B. subtilis a lo largo de la membrana citoplásmica. Imagen: Mol. Microbiol. 68: 1315–1327.
Hay más proteínas que se colocan en espiral en el interior de las bacterias de forma bacilar (las que como E. coli y B. subtilis son como un tubo), entre ellas está MreB, cuya ausencia provoca la pérdida de la forma y también la propia FtsZ y su acompañante FtsA, siendo éstas dos últimas parte de la maquinaria que se ensambla para formar el tabique de división.
REFERENCIA
I. Barák, K. Muchová, A.J. Wilkinson, P.J. O’Toole and N. Pavlendová. 2008. Lipid spirals in Bacillus subtilis and their role in cell division. Mol. Microbiol. 68: 1315–1327.

Excelente post, como son siempre los suyos, D. Miguel.
Un despilfarro evolutivo que haya dos mecanismos para conseguir el mismo fin: la ausencia del inhibidor MinC en el lugar en que se formará el elemento de separación citoplásmica. Y el sistema de desplazamiento, sencillamente, fascinante.
Pero… D. Miguel, úseme bien el lenguaje, que luego pasa lo que pasa. No es una ESPIRAL (la espiral es una curva plana), sino más propiamente una HÉLICE (que es una curva en el espacio).
Ustedes deben dar ejemplo de rigor, que si no resultan cosas como MEDIOAMBIENTE, por poner el ejemplo más escandaloso.
Gracias y no deje de escribir post. Es un gozo leerle.
Hola Ludovico,
la duplicación de los sistemas, algo que como verás ya usaron las bacterias, es un mecanismo de salvaguarda que luego se creyeron reinventar los humanos, por ejemplo los diseñadores de misiones espaciales para evitar al máximo los fallos.
Imagina que fueses bacteria y que el éxito de tus descendientes dependiese de que les pases tu información genética completa y suficiente citoplasma para vivir bien. ¿No lo comprobarías al menos dos veces? Por eso no creo que montar dos sistemas independientes sea malo, sino todo lo contrario. Como indica el dicho "lo barato sale caro" y no colocar bien el sitio por donde ocurre la división puede ser a la larga catastrófico.
En el caso de Bacillus existe, si cabe, una necesidad mayor de controlar la posición del septo, porque ha de ser lo suficientemente versátil como para adaptarse a colocarlo en el centro (división vegetativa), o a un cuarto de distancia del extremo (en la esporulación), y saber cuándo lo tiene que hacer por uno u otro sitio. Puedes buscar los trabajos de Jeff Errington o de Richard Losick para leerlo en más detalle.
Con respecto al uso del lenguaje, pues tienes razón, estrictamente hablando sería una curva helicoidal. Pero… te copio las acepciones de espiral que salen al consultar el diccionario de la RAE:
espiral.
1. adj. Perteneciente o relativo a la espira. Línea, escalera espiral.
2. f. Curva plana que da indefinidamente vueltas alrededor de un punto, alejándose de él más en cada una de ellas.
3. f. hélice (curva espacial).
4. f. Muelle espiral del volante de un reloj.
5. f. Sucesión creciente de acontecimientos. Espiral de violencia.
Como en inglés también "spiral" se usa para designar a la curva en 3D, creo que mantener "espiral" en la traducción no es tan horrendo como en principio puede parecer.
Un saludo
Miguel Vicente
Hola Miguel
Hablando de duplicación de sistemas. ¿No habrán dos espirales? Lo digo porque si hay una oscilación y una espiral es un monorail, las proteínas sólo podrían viajar en una dirección y no en la otra. Eso implica que, o hay un guardagujas, o hay una duplicación de la red viaria.
Opto por lo segundo
Un saludo
Me has dejado de piedra, Miguel, con la tercera acepción de espiral que da el DRAE. Hacer sinónimos espiral y hélice es una asombrosa muestra de ignorancia matemática y un empobrecimiento del idioma, al hacerlo impreciso. En fin… No se pueden pedir peras al olmo. El país, en ese campo y en algunos otros, no da para más.
Pero, aparte de este asunto secundario, mi duda es de otro tipo que lo apuntado en tu certera y clara respuesta.
La existencia de dos mecanismos sería un procedimiento de seguirdad si ocurriesen en la misma célula, pero en este caso suceden en dos especies distintas, E.c y B.s., cada una el suyo y uno solamente.
De ahí mi duda. Los sistemas de reproducción fueron muy primitivos en la evolución, por ser básicos para que la propia evolución pueda ocurrir: Sorprende la existencia de dos diferentes en especies que han de tener un antecesor común capaz de reproducirse. A no ser que la formación del septo, o el perfeccionamiento de esa formación haya sido una adquisición posterior. En ese caso sería interesante saber si existen otros mecanismos más simples, acaso anteriores evolutivamente.
Perdona la ignorancia desde la que te hago la siguiente pregunta:
¿Cómo lo hacen las arqueobacterias?. Por favor contéstame con lo que tengas a mano. No me mandes a la bibliografía que mi curiosidad no da para tanto trabajo, ni merece más esfuerzo por tu parte.
Un abrazo.
Hola Manuel,
las dos cosas. Hélices, usemos la palabra más exacta, puede que sean más de una, al menos en E. coli la hélice de MreB no coincide con lal de MinCD. Pero también ocurre que el desplazamiento de MinCD por acción de MinE incluye su separación de la membrana, lo clásico de cuando hay un atasco de tráfico, que todos querríamos que el coche volase. Lástima que en el mundo de los coches no exista un MinE que les haga volar…
Salud
Miguel Vicente
Hola Ludovico,
la duplicación de controles ocurre en la misma bacteria, si no no sería duplicación. E. coli tiene MinCDE, B. subtilis tiene MinCD-DivIVA y las dos tienen un sistema de oclusión por nucleoide, que si hemos de ponernos quisquillosos, es diferente en una y en otra.
En Arquebacterias se conoce mucho menos, pero si algo se sabe seguro que Manuel Sánchez te lo puede responder que de esos bichos él sabe más que yo.
Un saludo
Miguel Vicente
Se trata de un MALENTENDIDO:
Tú señalas dos sistemas de control. Yo NO ME REFIERO A ELLOS, sino ÚNICAMENTE a la proteína MinCD, que en una especie es obligada a abandonar el centro y en la otra especie es atraída hacia los extremos.
Lo que a mi me resultaba interesante desde un punto de vista evolutivo es la existencia de esa doble posiblidad, una en una especie y otra en la otra. No "encaja" en la economía de procesos y en el "bricolaje" que se observa en la evolución. Y preguntaba por un mecanismo más primitivo, previo a esos dos, acaso presente en algún antecesor y que haya perdurado hasta hoy.
Me gustaría que me contestases, siempre que no te suponga excesiva molestia, pues se trata de simple curiosidad y no merece la pena un esfuerzo mayor.
Efectivamente, mejor borrar para evitar un ruido superfluo y que no aporta nada.
Un abrazo.
Buenas
Aunque no es el tema que he empezado, pero bueno. Con permiso de Miguel.
Espiral viene de la palabra latina "spira" que era el término que se utilizaba para designar la rosca de un tornillo. Es decir, originariamente la palabra hacia referencia a una curva en tres dimensiones o hélice que comenzaba en un punto y luego se alejaba de él (la punta del tornillo). También se ha utilizado para describir la concha de los caracoles y por supuesto para definir un genero de cianobacterias, la Spirullina.
Sobre la división en el dominio Archaea, aunque hace un tiempo que ya deje de dedicarme a ellas le puedo decir a Ludovico que es algo entre los dos mundos. Por un lado parece que tiene rasgos eucariotas y por otro es un procariota. Pero también dependiendo de la rama. La última revisión sobre el tema es la de Rolf Bernarder sobre el genero Sulfolobus en la revista Molecular Microbiology (Rolf Bernander (2007) The cell cycle of Sulfolobus
Molecular Microbiology 66 (3) , 557–562). Este es un crenoarchaeota. Verás que en ella se habla de mitosis para referirse al alineamientoy segregación de los cromosomas. Incluso tienen genes homólogos a cdc6. Por ahora se desconoce que proteínas están implicadas en la división pero se sabe que no tienen FtsZ o algo similar. Sin embargo los euryarchaetoas (Halobacterium) si tienen un homólogo a FtsZ y se sospecha que su ciclo es más parecido al de los procariotas que a los eucariotas. Pero están bastante menos estudiados.
Sobre lo del "vuelo de MinE". ¿Cúal es el controlador aéreo? Porque si se despega alguien le tiene que volver a poner en el carril correcto ¿no? A lo mejor más que volar lo que ocurre es el mecanismo "palanca de emergencia" como esos dibujos animados estilo "taxi de Roger Rabbit" en los que el coche hace que sus ruedas se alarguen.
Para ver a lo que me refiero (minuto 2:11 del video):
http://es.youtube.com/watch?v=tb8XBV7nk3s
Un saludo
Hola Ludovico,
¿estás seguro de eso de la economía de los procesos? Como la evolución en las bacterias no la podemos documentar etapa por etapa, y como ya he comentado en otra respuesta (re: Respuesta taxonómica a Emilio) hemos de intentar deducir el pasado a partir de lo que nos revela el presente. El hecho de que en especies distintas los mecanismos que han perdurado sean diferentes no me parece extraño. ¿por qué? pues porque eso precisamente es lo que produce diversidad, y la diversidad ha debido ser la materia prima de la evolución.
Muy diferente es el caso de las reacciones bioquímicas, de los centros activos de las enzimas si se quiere concretar, en este caso la química permite muy pocas variaciones y la evolución solo ha podido jugar con pocas alterantivas, pero lo que es con interacciones entre proteínas y entre éstas y ácidos nucleicos, si la evolución fuese humana diríamos que se lo ha pasado en grande ensayándolo todo. Ya prometí también resumir un comentario que sobre la evolución de las redes reguladoras hemos escrito Jesús Mingorance y yo, cosa que haré en cuanto se pueda.
Como nota final, que B. subtilis y E. coli deben estar tan emparentados como un elefante y una esponja… o así.
Gracias por tus comentarios, lástima que no te identifiques más que con un seudónimo.
Un saludo
Miguel Vicente
Gracias sinceramente, Manuel y Miguel.
Buen ejemplo la comparación del elefante y la esponja. La verdad es que la diferencia, si se mira en el tubo de ensayo o en el microscopio, no es tanta.
Manuel, se me ocurren más nombres en tu línea. Spyrogira. Espirilos…, Menos mal que también está la Helicobacter pilori.
Repito. Gracias: Sois magníficos. Un abrazo.