![]()
Señales, errores y antibióticos
Algo similar a lo descrito hacen las arilomicinas pero con el sistema de secreción de proteínas de las bacterias. Como cualquier otro ser vivo, las bacterias sintetizan sus proteínas en el interior de la célula. Si una proteína debe ir fuera de la célula hay una maquinaria celular encargada de dirigirla o secretarla hacia el exterior. La distinción entre las proteínas que deben quedarse en el interior con aquellas que deben ir al exterior se debe sobre todo a una secuencia de aminoácidos llamada “péptido señal”. Toda proteína con ese péptido señal es secretada y una vez fuera, ese péptido señal es eliminado por una enzima especializada llamada señal-peptidasa. Y ese paso es necesario porque de lo contrario la proteína que mantiene ese péptido señal no se pliega correctamente y por lo tanto no puede ejercer su función (ver vídeo). Podría decirse que el péptido-señal es el sobre que indica la dirección de envío y la arilomicina lo que hace es distraer a la señal-peptidasa.
Muchas de esas proteínas que son secretadas al exterior son necesarias para la supervivencia de una bacteria, así que está claro que inhibir a la señal-peptidasa puede causar la muerte de la bacteria o por lo menos que su supervivencia no sea fácil. es importante señalar que la arilomicina es un antibiótico con un mecanismo muy peculiar. Nuestras células también tienen señal-peptidasas, pero son bastante diferentes a las señal-peptidasas bacterianas, por lo que en principio las arilomicinas parecen candidatas a ser un buen antibiótico.¿Y cuál es el “pero”? Cuando se descubrieron las arilomicinas en el año 2000 y se realizaron los primeros ensayos se vio que inhibían bastante bien el crecimiento de las Gram-positivas y no tanto a las Gram-negativas. Y según se siguió investigando se encontró que aparecían mutantes resistentes a las arilomicinas. Esos mutantes generalmente presentaban una señal-peptidasa modificada a la que la arilomicina no se conseguía unir. Todo parecía indicar que las arilomicinas iban a quedarse en una mera curiosidad bioquímica.
Sin embargo el grupo liderado por Christopher Heise de la empresa Genentech parece que ha encontrado un camino para “resucitar” como antibiótico a la arilomicina y usarla sobre todo para combatir a las Gram-negativas. La estructura de la arilomicina natural (ver figura inferior) consiste en un macrociclo tripeptídico con dos grupos fenólicos (área roja), un lipopéptido hidrofóbico (área morada) y un grupo polar carboxílico en el otro extremo (área verde). Lo primero que hicieron fue estudiar cómo se unía la arilomicina a la señal-peptidasa. Para ello cristalizaron la proteína con el antibiótico y así observaron que el macrociclo era la parte del antibiótico que se unía al centro activo de la enzima. Decidieron entonces que esa parte de la molécula no iba a ser alterada. Así que empezaron sintetizar variantes de la arilomicina en las cuales modificaban el lipopéptido, los fenoles o el grupo carboxílico, y a ensayar la efectividad de dichas variantes en la señal-peptidasa. La modificación de la cola lipopéptidica a una estructura más corta permitía que la molécula se uniera con mayor afinidad a la señal-peptidasa. La modificación de los fenoles también aumentaba la afinidad del antibiótico. Pero la modificación más importante fue sustituir el grupo carboxilo por un grupo nitrilo. Dado su carácter electrofílico, el grupo nitrilo se une covalentemente al sitio catalítico de la señal-peptidasa, inhibiéndola irreversiblemente.
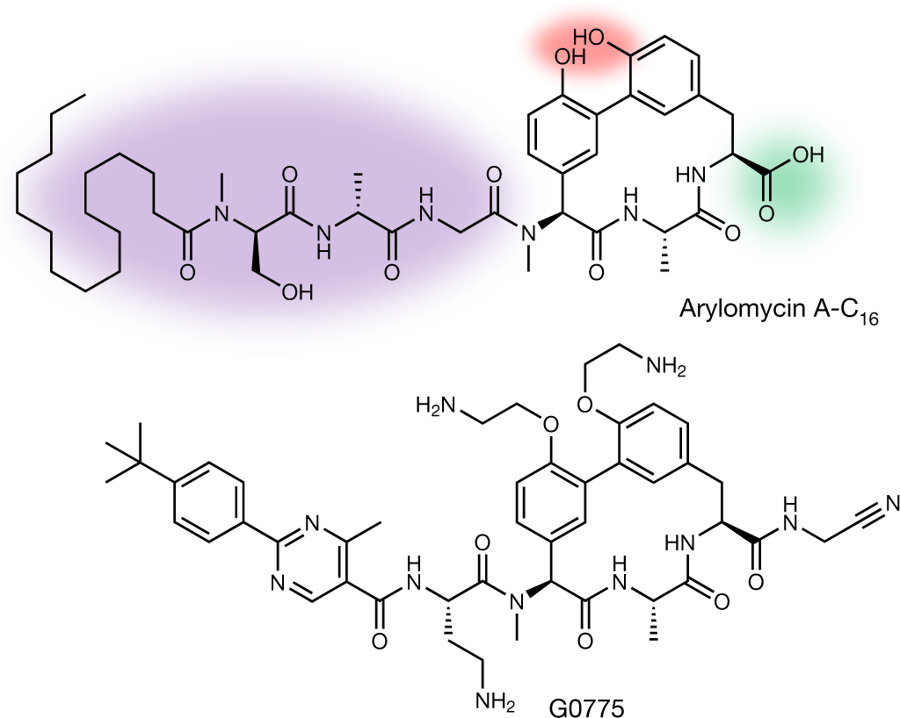
Tras diversas pruebas y combinaciones han conseguido una derivado de la arilomicina que parece bastante bueno. La molécula ha sido bauitzada como G0775 y es 500 veces más efectiva que la arilomicina. La han probado frente a patógenos resistentes a otras clases de antibióticos como son distintas cepas de Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y Acinetobacter baumanii. No solo eso, también la han probado en ratones infectados con K. pneumoniae y han constatado que funciona eliminando la infección. El próximo paso serán los ensayos clínicos con pacientes. Quién sabe, a lo mejor en unos pocos años tenemos un nuevo tipo de antibiótico disponible
Referencias:
Optimized arylomycins are a new class of Gram-negative antibiotics. Smith et al. 2018
The inhibition of type I bacterial signal peptidase: Biological consequences and therapeutic potential. Arryn Craney Floyd E. Romesberg 2015.

