![]()
Mis dudas sobre la bioética del ensayo clínico CombiVacS
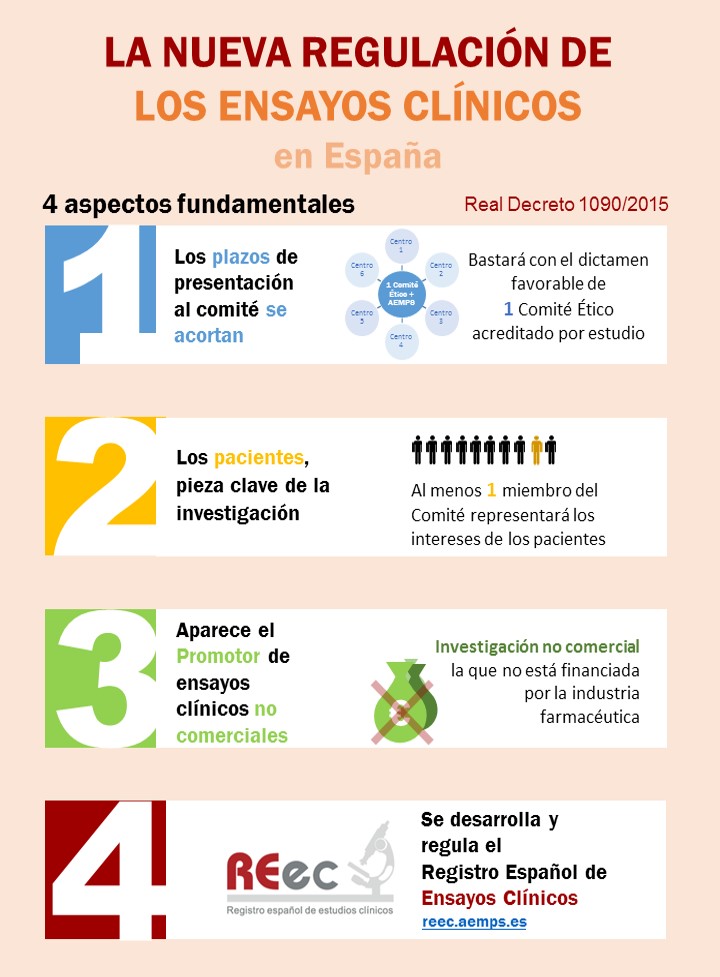
Reconozco que no soy un especialista en bioética. La poca que sé es porque me he leído algún que otro artículo para poder preparar mi clase sobre los ensayos clínicos que imparto a mis alumnos de Microbiología Industrial en 2º curso de Biotecnología. Siempre les insisto que en los ensayos clínicos se hacen experimentos con seres humanos y que por lo tanto es un proceso muy regulado. Incluso les pongo una diapositiva en la que les muestro la imagen que encabeza esta entrada y que resume los aspectos fundamentales del Real Decreto 1090/2015.
Con el poco conocimiento de bioética que tengo sé que las regulaciones modernas sobre la experimentación con seres humanos nacen con el llamado Código de Nuremberg. También sé que, según el RD 1090/2015, si planteas un ensayo clínico debes de pasar por un comité de bioética (Comité de Ética de la Investigación con medicamentos) constituido por un mínimo de diez miembros y en el que necesariamente debe de haber:
- Un médico farmacólogo clínico
- Un farmacéutico de hospital o de atención primaria
- Un graduado en enfermería
- Un representante de los pacientes.
En el Real Decreto se detallan las diferentes situaciones que pueden darse ya que no es lo mismo “estudio clínico” que “ensayo clínico” o que “ensayo clínico de bajo nivel de intervención”. Pero lo que sí está claro es que toda esa regulación es para evitar hacer daño a los pacientes. Y que si se lleva a cabo un ensayo clínico es porque se está muy seguro de que los posibles beneficios superan en mucho a los posibles perjuicios. Por eso no entiendo muy bien la decisión de llevar a cabo el ensayo clínico CombiVacS (Identificador 2021-001978-37) con 600 personas, ni la decisión del Ministerio de Sanidad de paralizar la vacunación con la vacuna de Astra-Zeneca hasta que se tengan los resultados de dicho ensayo.
Según la información del Registro Español de Ensayos Clínicos, el objetivo primario del CombiVacS es “Evaluar la respuesta inmune humoral contra el SARS-Cov-2, 14 días después de una vacunación con COMIRNATY en sujetos que recibieron una dosis única previa de VAXZEVRIA (G1), en comparación con la dosificación(G2)”. Esas 600 personas serán divididas en dos grupos asignados al azar en una proporción de 2: 1. Es decir, 400 personas recibirán 1ª dosis Astra-Zeneca + 2ª dosis Pfizer, mientras que las 200 personas del grupo control recibirán solo una dosis de Astra-Zeneca.
Y yo me pregunto, en el ensayo CombiVacS ¿realmente compensan los posibles beneficios a los posibles perjuicios?
Vayamos por partes. Primero los perjuicios.
- La evidencia científica disponible ha hecho que tanto la OMS y la EMA recomienden que se siga administrando la vacuna de Astra-Zeneca en las condiciones establecidas por los ensayos clínicos previos, realizados con decenas de miles de personas, y respaldados con los datos de farmacovigilancia actuales. Los riesgos de sufrir una trombosis no compensan el hecho de paralizar la campaña de vacunación ya que a menos gente inmunizada, más tiempo tardaremos en alcanzar la inmunidad de grupo. Eso es un perjuicio para todos.
- Se ha paralizado la vacunación de aquellos que han recibido la primera dosis con lo que, aunque tienen un cierto nivel de inmunidad, todavía tienen riesgo de infectarse (un pequeño inciso, no entiendo por qué el grupo control solo recibe la primera dosis de Astra-Zeneca y luego no recibe la segunda dosis). Así que es un perjuicio para ellos y si tenemos en cuenta el anterior punto, para todos.
- Hacer un ensayo clínico es caro. Con los escasos recursos para la ciencia que hay en España creo que el esfuerzo que se va a hacer se aprovecharía mejor en otra cosa si además tenemos en cuenta que este ensayo ya se está haciendo en Gran Bretaña (ver más abajo).
Yo creo que con esas tres situaciones un comité de bioética probablemente desaconsejaría la realización del ensayo CombiVacS. Pero como he dicho más arriba, los ensayos clínicos se permiten si los posibles beneficios superan en mucho a los posibles perjuicios. Y el Comité de Ética de la Investigación con medicamentos que ha evaluado el ensayo CombiVacS ha dado el visto bueno, por lo que ha debido de ver esos beneficios aunque en la página web el apartado «Justificación» aparece como «no aportado». Así que me tengo que preguntar ¿cuáles son esos beneficios que superan a los perjuicios? A bote pronto se me ocurren los siguientes.
- Disminución de los efectos secundarios más comunes debidos a la vacunación. Pero, con un grupo de 600 personas será difícil demostrar dicha disminución, salvo que sea algo muy evidente, ya que ambas vacunas provocan efectos secundarios parecidos.
- Disminución del riesgo de trombosis. No parece el caso ya que el mayor riesgo de trombosis se da en aquellos que han recibido la primera dosis de Astra-Zeneca, y en ambos grupos del ensayo se va a administrar dicha vacuna. Y además, dudo mucho que con 600 personas puedan determinar que dicho riesgo disminuye si tenemos en cuenta que ese rarísimo efecto secundario solo se da en 1 de cada 500.000 vacunados.
- Aumentar la eficiencia de inmunización. La vacuna AstraZeneca tiene una efectividad del 80%. La de Pfizer de un 95%. El mejor resultado posible es que la combinación de ambas fuera sinérgico y diera un resultado de un 100%. Un mal resultado sería si la eficacia sigue siendo similar a la de un 80% porque en ese caso se habrá hecho un pan con unas tortas. El peor resultado es que sea inferior a un 80%, aunque no creo que eso ocurra (aquí vuelvo a recordar el pequeño inciso que he hecho antes sobre mi falta de entendimiento de que el grupo control no reciba la 2ª dosis de Astra-Zeneca). En este apartado hay que decir que posiblemente tengamos datos sobre la eficacia de la combinación gracias a los ensayos clínicos COM-CoV que se están llevando a cabo en el Reino Unido desde hace un tiempo y con un mayor número de personas. Así que habría estado bien tener un poquito de paciencia, porque como he dicho más arriba, los recursos que tenemos son escasos.
En fin, seguramente se me ha escapado algo que el Comité de Ética de la Investigación ha visto muy claramente y por eso ha dado su visto bueno. Como he dicho al principio, yo no soy especialista en bioética y a lo mejor por eso no veo que los posibles beneficios superen en mucho a los posibles perjuicios.
P.S.:
El Servicio de Farmacología Clínica y la Unidad de Investigación Clínica y Ensayos Clínicos del Hospital Universitario La Paz coordinan el ensayo clínico Combivacs y, aunque prefieren no entrar en debates en las redes sociales, me hacen unas puntualizaciones que creo que deben publicarse:
– El ensayo clínico Combivacs cuenta con la aprobación del CEIm del Hospital Universitario La Paz y de la AEMPS y con el aval del consorcio europeo Vaccelerate (https://www.vaccelerate.eu), en el que participan 21 países europeos y colabora la propia EMA.
– El ensayo está promovido por el Instituto de Salud Carlos III, que es la entidad pública española de referencia a nivel internacional en materia de Salud Pública e Investigación Biomédica (www.isciii.es), y está coordinado por una de sus plataformas de apoyo a la investigación clínica (SCReN) (www.scren.es).
– CombiVacs es un ensayo clínico de fase II que tiene unos objetivos primarios de inmunogenicidad y seguridad bien definidos (que pueden verse en el enlace mostrado en el blog) y el tamaño muestral ha sido calculado para responder a esos objetivos. La controversia generada en torno a este estudio deriva en gran medida de hacer una lectura que va más allá de los objetivos planteados.
– Una de las prioridades de Vaccelerate es dar respuesta a preguntas no contestadas por los ensayos clínicos desarrollados por la industria farmacéutica. Este consorcio, en colaboración con la Comisión Europea y con la asesoría de la EMA decidió que sus dos primeras prioridades eran hacer ensayos de uso heterólogo de vacunas y de espaciamiento de dosis, usando variables subrogadas de inmunogenicidad.
J. Mingorance
ACTUALIZACION 13 de mayo de 2021
Se ha publicado la siguiente noticia «Combinar dos vacunas diferentes contra la covid multiplica las reacciones adversas» en la que se resumen los resultados preliminares del ensayo británico Com-Cov en la revista The Lancet.

According to the ICH-GCP guidelines all clinical trials should be conducted in compliance with ethical standards, clear scientific proof, and benefit overweigh