![]()
¿Un talón de Aquiles en el astuto bacilo de Koch?
Jesús Mingorance y Goosen López. Hospital Universitario La Paz
Miguel Vicente. Centro Nacional de Biotecnología
El Mycobacterium tuberculosis o bacilo de Koch, la micobacteria, es la bacteria responsable de la tuberculosis, una enfermedad que acompaña desde hace milenios a la humanidad. Es un patógeno profesional, y aunque puede cultivarse en el laboratorio, en la naturaleza no se le conoce otro hábitat aparte del ser humano.
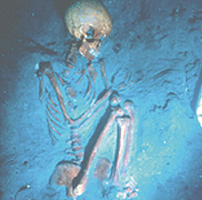
Larga y peligrosa convivencia. En la costa de Israel se han encontradoesqueletos de personas, que vivieron hace ya 9000 años, con señales dehaber padecido tuberculosis.
Las cifras de la Organización Mundial de la Salud son abrumadoras: un tercio de la población mundial ha sido infectado en algún momento y aunque la mayoría de estas infecciones permanecen latentes, en la décima parte se desarrollará una tuberculosis activa que si no se trata correctamente será mortal en la mitad de los casos. Pese a este desolador panorama, la tuberculosis es una enfermedad tratable con antibióticos, y responde bien al tratamiento, es decir, en la mayoría de casos se cura.
La mayoría de las resistencias a los antituberculosos (que es como se llaman los antibióticos utilizados contra la micobacteria) surgen por mutaciones puntuales espontáneas. Esto quiere decir que en cualquier población suficientemente grande existen algunas micobacterias resistentes a un antibiótico. Es muy poco probable, sin embargo, que exista en un enfermo un mutante doble, el que es resistente a dos fármacos a la vez (para ello sería necesario que albergase en su cuerpo una población enorme de micobacterias). Durante el tratamiento se eliminan selectivamente las micobacterias sensibles, que en principio son la gran mayoría, lo que generalmente conduce a la curación. Pero si el tratamiento se interrumpe antes de tiempo puede suceder que no solo rebrote la enfermedad, sino que ahora las bacterias que la producen puedan ser en su mayoría resistentes a alguno de los antibióticos de primera línea. El peligro es que en este caso, la probabilidad de que existan células portadoras de una segunda mutación que confiera resistencia a otro fármaco deja de ser ínfima para convertirse en algo posible. Los tratamientos inadecuados, ya lo sean por no haberse completado, por haberse aplicado de forma intermitente, ó parcial (tomando alguno de los fármacos, pero no todos), han contribuido a que durante las últimas décadas hayan aparecido micobacterias llamadas MDR (multiresistentes) que son refractarias al tratamiento con dos o más antibióticos de primera línea. En éste caso se deben aplicar otros tratamientos que son menos efectivos, tienen efectos secundarios más molestos e incluyen ya un inyectable. Por otra parte, la tuberculosis MDR, aunque se trate, tiene un pronóstico mucho menos favorable. Más recientemente han aparecido cepas llamadas XDR, con resistencias expandidas, que además de tener las mismas resistencias que las MDR también son resistentes al menos a dos antibióticos de segunda línea incluyendo a uno de los inyectables.
¿Por qué es tan difícil acabar con la micobacteria? Su estrategia defensiva es compleja, y probablemente es el resultado de una larguísima evolución cuyas últimas etapas han sido bastantes milenios de interacción con nuestro sistema inmunológico. Parece obvio que el objetivo de la micobacteria no ha sido el evolucionar para ser resistente a los tratamientos clínicos, que al menos hasta mediados del siglo XX no existían, sin embargo las tácticas que utiliza para defenderse del sistema inmune también pueden ser útiles frente a los tratamientos farmacológicos. A continuación detallamos algunas de las tácticas de supervivencia de la micobacteria.
Táctica 1: Blindaje. Ya se comentó en otro artículo que las micobacterias poseen una doble capa protectora, mucho más parecida a la cubierta de las bacterias Gram-negativas, que son bastante resistentes a los antibióticos como la penicilina. El blanco de la penicilina es el peptidoglicano, y en estos casos está enfundado entre una capa de lípidos externa y la membrana celular, mientras que en las bacterias Gram-positivas, las más sensibles a la penicilina, el peptidoglicano está en contacto directo con el exterior.
Táctica 2: Camuflaje. Una de las características típicas de la tuberculosis es la formación del granuloma, una lesión inflamatoria crónica formada por macrófagos que rodean una masa de células y bacterias que se creía estaban muertas. Se consideraba antes al granuloma como una estructura para contener y eliminar al agente infeccioso pero ahora se sospecha que el granuloma es también una de las estrategias que utiliza la micobacteria para propagarse al inicio de la infección y para diseminarse. Además el granuloma es un auténtico escondrijo en el que las micobacterias vivas pueden zafarse de los ataques del sistema inmune y resistir mejor a los antibióticos, que no penetran fácilmente en su interior.
Táctica 3: Paciencia. Los antituberculosos, como la mayoría de los antibióticos, son inhibidores de actividades metabólicas esenciales. Entre los antibióticos de primera línea para combatir a la tuberculosis se incluye un inhibidor de la síntesis de ARN mensajero y tres inhibidores que bloquean la síntesis ó la incorporación de ácidos micólicos o de ácidos grasos a la pared celular. Pero la micobacteria tiene un metabolismo muy lento comparado con otras bacterias, su ciclo celular puede estar en torno a las 16 a 24 horas, y esto hace que la concentración de cada fármaco deba mantenerse dentro de los niveles terapéuticos adecuados durante el suficiente tiempo, de varios meses como ya dijimos, para que la inhibición resulte eficaz para matarla. Mientras el enfermo acaba cansándose y a veces abandona, la bacteria prosigue lenta pero implacable.
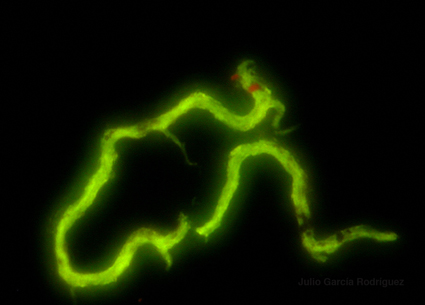
Un dragón mortífero. En los cultivos líquidos las células de Mycobacterium tuberculosis tienden a agruparse y a formar grumos con forma de cordones. Esta sugerente imagen muestra un cordón teñido con auramina. Fotografía: Julio Rodríguez-García (Servicio de Microbiología, Hospital Universitario La Paz).
Táctica 4: Eficacia. La micobacteria vive despacio, pero dista mucho de ser una bacteria torpe. Más bien podría decirse que es meticulosa y extremadamente eficaz. La dosis infectiva de la micobacteria es muy baja, diez bacterias, la cantidad que contiene la gota de un estornudo son más que suficientes para provocar la infección, incluso se sospecha que una célula viva puede bastar para producir una infección, ó para hacer fracasar un tratamiento.
Táctica 5: El proyectil antiproyectil. Como dijimos, los antibióticos de la familia de la penicilina (beta-lactámicos) no son eficaces contra las micobacterias, y ello pese a que el elemento central de su pared celular es el peptidoglicano, y poseen PBPs, que son las enzimas que sintetizan peptidoglicano y las dianas de los antibióticos beta-lactámicos. De hecho, en el tubo de ensayo los antibióticos beta-lactámicos se unen a las PBPs purificadas de micobacterias igual que a las de otras bacterias. Sin embargo, en la célula viva, la baja permeabilidad de su peculiar pared celular, junto con la presencia de una beta-lactamasa muy activa, inutilizan de manera muy efectiva a esta clase de antibióticos. La función natural de las beta-lactamasas, que participan en el metabolismo de la pared celular, puede que no sea la eliminación de antibióticos. Sin embargo, por las mismas razones por las que los antibióticos beta-lactámicos inhiben a las PBPs, porque encajan en su sitio activo y lo bloquean, son ellos mismos degradables ya que igualmente encajan en el sitio activo de las beta-lactamasas en donde son destruídos. Muchos microorganismos producen beta-lactamasas de manera natural, pero muy pocas de ellas son tan activas como las de las micobacterias. La razón probablemente estribe en que la propia complejidad de la pared celular de la micobacteria dificulta el acceso de la enzima a su lugar de acción y por ello se requiere un nivel de actividad mucho mayor. En todo caso, la beta-lactamasa estaba ahí mucho antes de que empezase a usarse la penicilina como medicamento, pero proporciona una resistencia natural muy efectiva contra esta familia de antibióticos.
Una estrategia de ataque nueva. Sí, pero sacada del manual. Ante este panorama, y con la amenaza de las nuevas cepas XDR, la necesidad de nuevos fármacos contra la micobacteria es acuciante, y la búsqueda continúa en múltiples frentes. En un trabajo publicado recientemente se retoman los beta-lactámicos y se demuestra que una combinación de meropenem y ácido clavulánico podría ser útil para combatir la micobacteria. Los dos fármacos son viejos conocidos, están aprobados por las autoridades correspondientes en todo el mundo, se usan habitualmente para combatir otros tipos de infecciones y carecen de efectos secundarios significativos. ¿Entonces, cuál es la novedad? El meropenem es un beta-lactámico de uso hospitalario (no espere encontrarlo en la farmacia de la esquina y mucho menos, como erróneamente se ha dicho en algún medio, en el botiquín casero) de la familia de los carbapenems activo contra un amplio espectro de bacterias. El ácido clavulánico se usa en combinación con antibióticos beta-lactámicos para evitar su degradación por las beta-lactamasas, a las que inhibe, y así potenciar su efecto. Los investigadores observaron que el meropenem es un mal sustrato para la beta-lactamasa de Mycobacterium tuberculosis y se hidroliza muy lentamente, por lo que razonaron que la combinación de meropenem y ácido clavulánico en dosis similares a las terapéuticas podría ser útil contra la micobacteria, y de hecho comprobaron que en cultivos de laboratorio, la combinación es efectiva tanto contra las cepas de laboratorio como contra una colección de aislados clínicos del tipo XDR. Ahora hay que demostrar que la combinación es eficaz también en los enfermos, y ya están en marcha ensayos clínicos dirigidos a ello. Teniendo en cuenta la estrategia defensiva de la micobacteria, parece poco probable que esta sea el arma definitiva contra la tuberculosis, sin embargo, en esta larga guerra hay muchas batallas, y todas las armas pueden resultar útiles en algún momento.

Dios permita comunicarme con algunos de ustedes de corazon le pido que me ayuden. Mi papá tiene esa emfermedad tuberculosis cerebral el estaba trabajando en una finca y la posee con el tratamiento que le dan ustedes es para probar y darle a la ciencia lo que quiere Dios los bendiga
¿Existe alguna información acerca de la simbiosis entre Mycobacterium tuberculosis y el COVID19, en relación a que el virus pueda usar la maquinaria celular del Mycobacterium para reproducirse?
Sería un milagro, porque el SARS-CoV-2 precisa la maquinaria molecular de la célula eucariótica como la humana. Mycobcterium es un procariota y no tiene nada que ver. Además que el virus precisa entrar al interior celular usando proteínas de la superficie que no existen en bacterias.