![]()
Aplicación del proceso Fenton a alta temperatura al tratamiento de aguas residuales industriales
La aplicación del proceso Fenton a alta temperatura supone una alternativa real y eficiente para el tratamiento de efluentes industriales de cara a reducir tanto el contenido en materia orgánica como su toxicidad.
[Grupo Ingeniería Química UAM]
La necesidad de desarrollar soluciones técnicas capaces de cumplir con los cada vez más exigentes límites de vertido de aguas residuales industriales o que permiten el reciclaje o la reutilización del agua, dirigen los esfuerzos en investigación bien hacia la aplicación de nuevos tratamientos o hacia la intensificación de los ya disponibles. El proceso Fenton constituye una alternativa de tratamiento para una amplia variedad de efluentes industriales [1]. Este proceso implica la generación de radicales •OH a partir de la descomposición catalítica del H2O2 por medio de Fe2+ en medio ácido.
La aplicación del proceso Fenton al tratamiento de aguas residuales industriales ha sido, hasta ahora, limitada debido a los altos requerimientos tanto de H2O2, lo que supone un elevado coste de operación, como de hierro, que implica la generación de importantes volúmenes de lodos de Fe(OH)3 tras la etapa de neutralización previa a su vertido. Recientes estudios [2] han puesto de manifiesto la viabilidad de operar a altas temperaturas, aumentando significativamente la velocidad de reacción y el grado de mineralización, y reduciendo las dosis de H2O2 y Fe2+ necesarias. El objetivo de este trabajo es estudiar la viabilidad del proceso Fenton a alta temperatura para el tratamiento de aguas residuales industriales procedentes de una planta de productos fitosanitarios.
Los experimentos se realizaron en un reactor encamisado tipo tanque agitado que opera en discontinuo. La velocidad de agitación se fijó en 200 rpm y el volumen de reacción fue 500 mL. Se operó a 120 ºC y pH 3. Se realizaron ensayos con 10 y 100 mg/L de catalizador (Fe2+), variando la dosis de oxidante (H2O2) entre el 20% y el 100% de la cantidad estequiométrica con respecto a la DQO (2,12 gH2O2/gDQO).
La evolución del proceso se siguió a través de la DQO y COT remanente, a conversión completa de H2O2. De esta forma se evitan interferencias en la medida de DQO, que se llevó a cabo con dicromato potásico siguiendo el método ISO 6060. Por su parte, el COT se determinó mediante un analizador de COT.
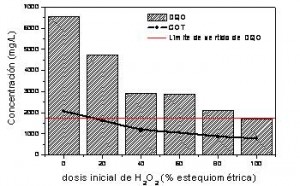
El aumento de la dosis de oxidante implica mayores reducciones de DQO y COT (Figura 1). Como se aprecia en esta figura, empleando la cantidad estequiométrica de H2O2 y 10 mg/L de catalizador, es posible reducir la DQO en un 74%, hasta 1700 mg/L, valor inferior al límite de vertido a la red de integral de saneamiento establecido por la Comunidad de Madrid (Ley 10/1993).
Figura 1. Influencia de la dosis de H2O2 (referida a la estequiométrica) en la evolución de DQO y COT. (Cond. operación: pH=3; T=120ºC; [Fe2+]=10mg/L)
Con respecto a la dosis de catalizador, un aumento de la concentración de Fe2+ hasta 100 mg/L no influyó en la eficiencia del proceso en términos de reducción de COT y DQO, si bien la velocidad de reacción aumenta significativamente, aunque también la producción de residuos y por lo tanto el coste global del proceso.
BIBLIOGRAFÍA
[1] P. Bautista, A.F. Mohedano, J.A. Casas, J.A. Zazo, J.J. Rodríguez, J. Chem. Technol. Biotechnol.10 (2008) 1323.
[2] J.A. Zazo, G. Pliego, S. Blasco, J.A. Casas, J.J. Rodríguez, Ind. Eng. Chem. Res.50 (2011) 866.