![]()
Ciclo del Azufre en Agroecosistemas y Reacción de los Fertilizantes Azufrados en el Suelo
Ing.Agr. Esp. Martín Torres Duggan*
Tecnoagro SRL y Comité de Fertilidad y Nutrición
Vegetal-Asociación Argentina de la Ciencia del Suelo
(AACS)
¿Cuáles son las formas de azufre en el suelo?
El rango típico de concentración total de S en suelos agrícolas de regiones húmedas y sub-húmedas es 0,1-
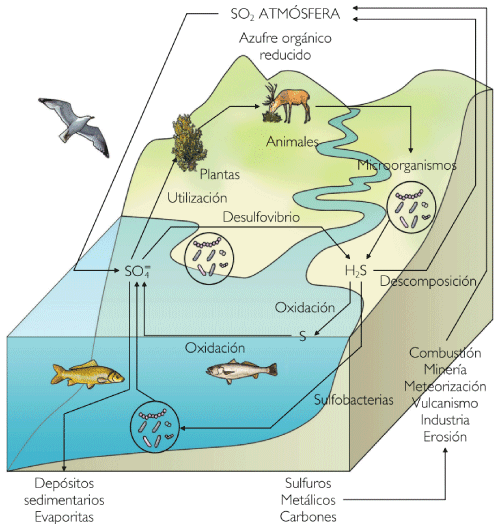
Ciclo del Azufre. Fuente: Kalipedia.
La comprensión de la naturaleza y propiedades de las formas orgánicas de S en suelos resulta muy relevante, debido a que las mismas gobiernan la liberación de S disponible para los cultivos. Existen diversos enfoques para realizar fraccionamientos de S orgánico: extracción química seguida de separación físico-química en ácidos húmicos, fúlvicos y huminas; separación física a través de tamaño de fracciones organo-minerales y fraccionamientos moleculares. En cuanto a las formas químicas de S en suelos, si bien gran parte de los compuestos orgánicos edáficos continúan sin identificarse, de acuerdo con Tabatabai (2005), es posible mencionar tres grupos de compuestos orgánicos azufrados:
1-S orgánico que no está directamente unido con el carbono (C) y corresponderían a ésteres de sulfatos con uniones C-O-S (e.g., arilsulfatos, sulfato fenólico, polisacáridos sulfatados, entre otros). Otros compuestos orgánicos podrían estar presentes como sulfamatos (C-N-S) y tioglucósidos sulfatados (N-O-S). Esta fracción puede representar entre 30 y 60 % del S total orgánico, con una media del 50 %, en suelos de regiones húmedas y subhúmedas.
2-S orgánico directamente unido a C (C-S). Esta fracción correspondería en gran medida a S en forma de aminoácidos como metionina, cistina y cisteína. La concentración en suelo varía entre 10 y 30 % del S orgánico total, pero se han reportado valores de hasta 58 % en suelos de Québec (Tabatabai, 2005).
3-S orgánico no reducido por los reactivos utilizados en la estimación de las fracciones 1 y 2. Esta fracción se halla en el rango de 30 a 40% del S orgánico total. Considerando su gran resistencia a la degradación química, es una fracción de escaso valor como fuente de S disponible para las plantas.
En
El ciclo del S en el sistema suelo-planta está gobernado por procesos biológicos y físico-químicos, con activa participación de la biota del suelo (Haneklaus et al., 2007). La fertilización con S ya sea en forma de SO42- o como Sº representa el principal ingreso de S. Otros aportes que pueden ser importantes son el riego y las capas freáticas. La contribución de las formas gaseosas de S son poco significativas en áreas alejadas de centros urbanos, industriales o distantes del mar. Las principales pérdidas o salidas de S de los agro-ecosistemas corresponden a la remoción por los productos cosechados, lixiviación y escurrimiento. La adsorción y las pérdidas gaseosas desde la superficie del suelo o desde las plantas presentan menor relevancia (Haneklaus et al., 2000). Los principales biogeociclos internos del S en suelos son la mineralización-inmovilización y la oxidación.
La mineralización es el proceso por el cual el S presente en las fracciones orgánicas edáficas se transforman en SO42- biodisponibles para las plantas. En el caso del S y a diferencia de lo que ocurre con el N, es posible diferenciar dos tipos o mecanismos de mineralización: mineralización biológica y mineralización bioquímica (Anderson et al., 2006, Heneklaus et al., 2007). La mineralización biológica de S está determinada por la demanda microbiana de C para proveer energía para su crecimiento, liberando SO42- como subproducto de la oxidación del C a CO2. La transformación se realiza principalmente a través de microorganismos, por lo cual los factores que afectan la actividad microbiológica (e.g., temperatura, humedad, pH y disponibilidad de sustrato) también influyen en los procesos de mineralización, inmovilización, oxidación y reducción. Este proceso es similar al de la mineralización del N. La mineralización bioquímica, en cambio, implica la liberación de SO42- desde el pool de sulfato-ésteres a través de una hidrólisis enzimática. La arilsulfatasa es la principal enzima catalizadora en suelos. El “pool” de éster sulfato (S-O) tiene importancia en la mineralización de corto plazo, mientras que el S ligado al C, constituye una fracción importante para la mineralización de largo plazo. La contribución de la mineralización a la demanda de S del cultivo es baja (1,7-3,1%). Por lo tanto, en esquemas de alta productividad, la fertilización azufrada constituye una herramienta fundamental para sostener los requerimientos de S de los cultivos.
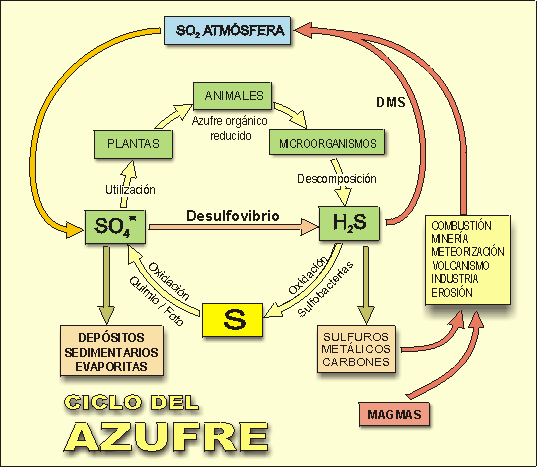
Figura 1. Ciclo del azufre en el sistema suelo-cultivo
(Kansas State University)
¿Cuál es la función del azufre en las plantas y su importancia en la producción vegetal?
El S es un elemento esencial para la nutrición vegetal, con requerimientos similares a los de fósforo (P), pero considerablemente más bajos que nitrógeno (N) y potasio (K). Las raíces absorben S como SO42- y luego lo reducen dentro de la planta durante la síntesis de compuestos orgánicos. A diferencia de lo que ocurre con el N, el S presenta escasa movilidad dentro de la planta, determinando que los síntomas de deficiencia se observen en las hojas más nuevas. El S participa en importantes procesos bioquímicos y fisiológicos en las plantas superiores como la biosíntesis de proteínas y lípidos, fotosíntesis, asimilación de N, fijación biológica de N, entre otras (Mengel y Kirkby, 2000; Rice, 2007).
La concentración de S en tejidos vegetales varía considerablemente según la familia y especie botánica y se encuentra asociado con el requerimiento fisiológico. En general, las gramíneas presentan menor concentración de S en tejidos que las dicotiledóneas. El índice de cosecha medio del S (i.e., proporción del S en grano en relación a la biomasa total) es más bajo que en N o P. El requerimiento y extracción de S en base seca es 5, 4 y
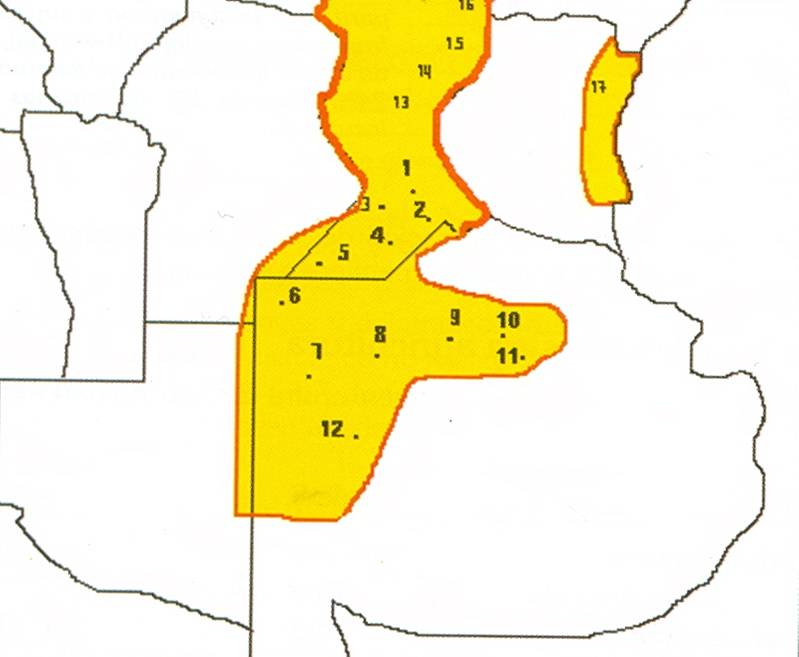
Figura 2. Regiones con deficiencias de azufre en la Región
Pampeana argentina (Darwich, 2005). Los números
corresponden a localidades.
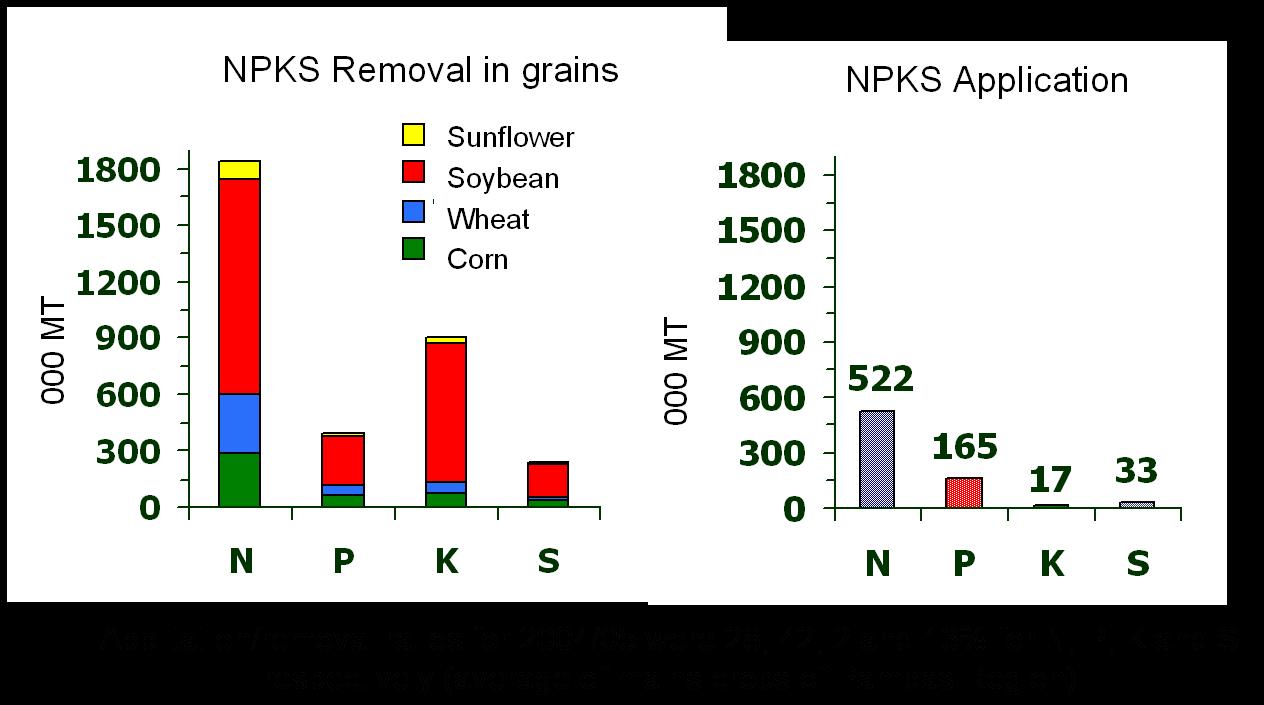
Figura 3. Balances de nitrógeno (N), fósforo (P),
potasio (K) y azufre (S) en la Región Pampeana.
Razones de insumos/exportaciones para el periodo
2004-2005 con dosis de 28% 42%, 2% y 13% de
N, P, K. S, respectivamente.
¿Cuáles son los principales fertilizantes azufrados utilizados en la agricultura?
La mayor parte de las fuentes azufradas utilizadas en agricultura presentan el S como SO42- y varían desde muy poco solubles (e.g., yeso agrícola) a muy solubles (e.g., sulfato de amonio, sulfato de magnesio). Como fuentes insolubles sólidas, la más importante es el Sº, que primero debe oxidarse a SO42- para ser aprovechado por las plantas (PPI, 1997). En
Tabla 1. Principales fuentes azufradas utilizadas en agricultura
(adaptado de Fertilizer Manual, 1998 e PPI, 1997)
Fertilizante Fórmula química % de S Forma S Estado de agregación
Sulfato de amonio (NH4)2SO4 24 SO42- Sólido
Tiosulfato de amonio (NH4)2S2O3 26 S2O32- Líquido (solución)
Sal de Epsom MgSO4.7H2O 13 SO42- Sólido
Yeso agrícola CaSO4 . 2H2O 12-18 SO42- Sólido
Sulfato de magnesio hidratado Mg SO4 . H2O 22 SO42- Sólido
Sulfato de magnesio anhidro Mg . SO4 26 SO42- Sólido
Sulpomag K2SO4 2 .MgSO4 22 SO42- Sólido
Sulfato de potasio K2SO4 18 SO42- Sólido
Azufre elemental S° 30-100 S° Sólido
Superfosfato simple Ca (H2PO4)2
+CaSO4.2H2O 14 SO42- Sólido
Superfosfato triple Ca (H2PO4)2
+CaSO4.2 H2O <1 SO42- Sólido
En
En el ámbito agropecuario, el azufre elemental (AE) es utilizado principalmente como enmienda para corregir la alcalinidad de suelos. Sin embargo, el uso del AE como fertilizante azufrado, también representa un destino relevante. El consumo de AE registró un importante crecimiento a nivel global, sobre todo en regiones como China, Africa y Latinoamérica. En la Argentina el uso de esta fuente es escasa, pero con un potencial interesante, tanto en como fuente azufrada individual, como formando parte de fertilizantes compuestos.
¿Cómo reaccionan los fertilizantes azufrados en el suelo?
Los fertilizantes azufrados solubles en agua (e.g. SPS, yeso, sulfato de amonio, etc.) una vez aplicado en el suelo y solubilizado el gránulo se encuentra disponible para las plantas. El SPS presenta una reacción inicial relativamente ácida, el yeso presenta reacción neutra y el sulfato de amonio una reacción ácida. Una vez disuelto los gránulos del fertilizante, el sulfato ingresa en las interacciones del suelo y también de las plantas, quedando sometido a los diferentes procesos mencionados previamente (absorción por las plantas, pérdidas, etc.).
La disponibilidad de S del AE depende tanto de factores vinculados con el tipo de mineral (área superficial específica), tipo de suelo (actividad microbiana, pH, MO, etc) y también de las condiciones ambientales tras la aplicación, fundamentalmente temperatura y humedad. El azufre elemental (S°), cuando se trata de productos con elevada pureza, puede contener más del 95% de S. Se lo utiliza tanto como acidificante de suelos, como fuente de S en productos complejos y mezclas físicas. El S elemental, debe oxidarse en el suelo para luego producir sulfatos disponibles para los cultivos.
S° + 2 02 + H2O —› H2SO4
Esta reacción, generadora de acidez, esta mediada principalmente por bacterias del género Thiobacillus y como en todo proceso biológico, la velocidad de la reacción esta determinada básicamente por la temperatura y en este caso particular también por el potencial de óxido- reducción del suelo. Otros factores que inciden en la tasa de disolución y reacción del producto son el tamaño de partícula y la forma de aplicación. Si bien se ha detectado oxidación microbiana a bajas temperaturas (4° C), el rango térmico óptimo se encuentra entre 25 y 35 °C, siendo muy lento a temperaturas menores a 10 °C (Darwich, 1998).

señor.
reciba un cordial saludo,le escribo desde potosi-bolivia
para indicarle que en esta todavia no se sta aplicando
con el azufrey el yeso.
nosotros en esta tenemos por cantidades estos materias primas.por favor indicarme como puedo preparar para mis sembradios.
agrdecere muy deveras por su coperación.
atte. agustin
esta muy buena!!!!! esta pagina me encanta me ayuda a
prender un poco mas saludos a quien la realizo…….. besos
Excelente informacion y sobretodo muy completa sigan asiii nos estan ayudando mucho.. y de gran manera……… saludos.!!!!!!!!!
¿Es recomendable aplicar sulfato de magnesio granulado en suelos con pH menores a 5.4 (suelos ácidos)?
¿Por qué si en el suelo tengo 3 meq/100 gr de suelo de Ca en la planta el nivel de calcio es muy bajo? cabe recalcar que las relaciones entre cationes están muy bien, pero si se presenta en el suelo pH de 5.6
Cuál es la relación correcta de cationes a nivel foliar para una planta de banano y cuál es el % correcto de presencia de los cationes K, Ca y Mg a nivel foliar..?